Chemical evolution of amino acids and proteins ? Impossible !! https://www.youtube.com/watch?v=1L1MfGrtk0A
https://reasonandscience.catsboard.com/t2887-chemical-evolution-of-amino-acids-and-proteins-impossible
The problem of getting nitrogen to make amino acids and DNA on early earth 2:41
The problem of getting all amino acids used in llife by origin of life experiments 4:20
The problem of selecting 20 amino acids prebiotically out of hundreds supposedly existing on early earth. 6:08
The problem of concentrating the amino acids used in life at one assembly site. 7:15
The problem of understanding why life uses 20 amino acids, and not more or less. 9:00
The problem of homochirality 12:23
The problem of amino acid synthesis regulation 13:43
The problem of peptide bonding of amino acids to form proteins 14:12
The problem of linking the right amino acid side sequence together 17:15
The problem of getting the right forces to stabilize proteins - essential for their correct folding 19:32
The problem of hierarchical structures of proteins 19:50
In order to have a functional protein, you need to have amino acids.
In order to have the amino acids used in life, you have to select the right ones amongst over 500 that occur naturally on earth.
To get functional ones, you need to sort them out between left-handed and right-handed ones ( the homochirality problem). Only left-handed amino acids are used in cells.
There is no selection process known besides the one used in cells by sophisticated enzymes, which produce only left-handed amino acids.
Amino acids used for life have amino groups and carboxyl groups. To form a chain, it is necessary to have the reaction of bifunctional monomers, that is, molecules with two functional groups so they combine with two others. If a unifunctional monomer (with only one functional group) reacts with the end of the chain, the chain can grow no further at this end. If only a small fraction of unifunctional molecules were present, long polymers could not form. But all ‘prebiotic simulation’ experiments produce at least three times more unifunctional molecules than bifunctional molecules.
The useful amino acids would have to be joined and brought together at the same assembly site in enough quantity.
There are four different ways to bond them together by the side chains. if bonded to the wrong side chain, no deal.
The formation of amide bonds without the assistance of enzymes poses a major challenge for theories of the origin of life.
Instructional/specified complex information is required to get the right amino acid sequence which is essential to get the functionality in a vast sequence space ( amongst trillions os possible sequences, rare are the ones that provide function )
Before amino acids would join into a sequence providing functional folding, it would disintegrate if hit by UV radiation.
But even IF that would not be the case, most proteins become only functional, if they are joined into holo-enzymes, where various amino acid chains come together like lock and key.
If that would occur, the tertiary or quaternary structure in most cases would bear no function without the insertion of a co-factor inside the pocket, like retinal in the opsin pocket, forming rhodopsin.
But even IF there would emerge a functional protein on the early earth, by itself, it would be like a piston outside the engine block of an automobile. Many proteins bear only function once they are integrated in an assembly line, producing sophisticated molecular products used in life.
But even IF we had an assembly line of enzymes producing a functional product, what good would there be for that product, if the cell would not know where that product is required in the Cell?
For example, chlorophyll requires the complex biosynthesis process of 17 enzymes, lined up in the right order, each producing the substrate used by the next enzyme. But chlorophyll has no function unless inserted in the light-harvesting antenna complex used in photosynthesis to capture light and funnel it to the reaction center.
But even if that complex, chlorophyll and the LHC would be fully set up, they have no function without all over 30 protein complexes forming photosynthesis, used to make hydrocarbons, essential for all advanced life forms.
Now, let's suppose all this would assemble by a freaky random accident on early earth, there would still be no mechanisms of transition from a prebiotic assembly, to Cell factory synthesis.


Origin of life assumptions started with the idea that the environment where life emerged was a complex solution of abiogenic organic molecules either in the primitive ocean of some warm little pond, including amino acids and sugars—in other words, all the monomers required for the synthesis of biopolymers.

In a letter to his friend J.D. Hooker, Darwin wrote in 1871:
But if (& oh what a big if) we could conceive in some warm little pond with all sorts of ammonia & phosphoric salts,—light, heat, electricity &c present, that a protein compound was chemically formed, ready to undergo still more complex changes
The best-known theory is the spontaneous generation, in other words, abiogenesis, by a “Prebiotic soup”, a theory hypothesized by Oparin in 1924 (Oparin, 1957).
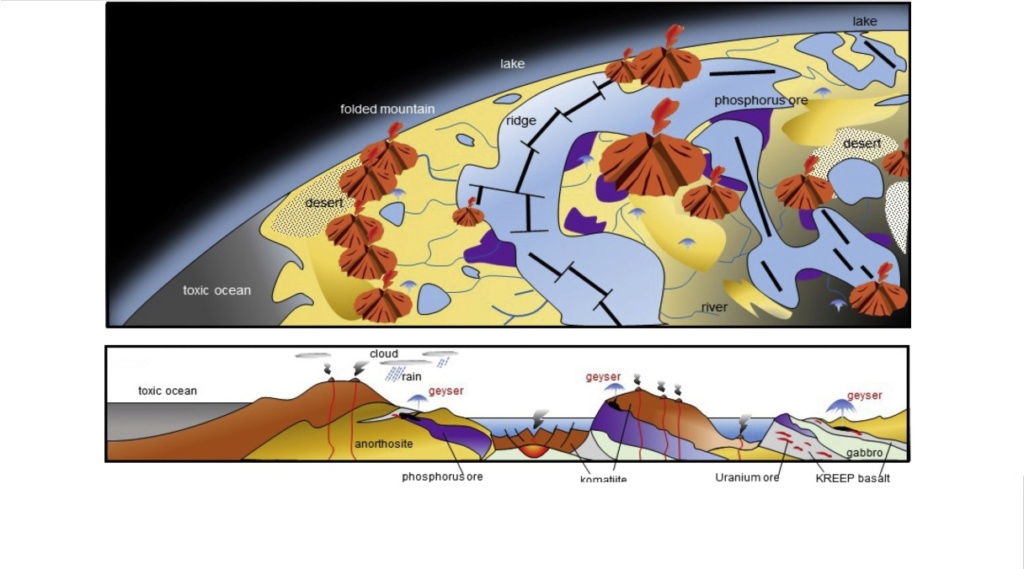
In this theory, organic compounds were created in a reductive atmosphere from the action of sunlight and lightning.

It was claimed that the atmosphere was primarily anoxic, consistent of ammonia, methane, carbon dioxide and water vapor.
The compounds were then dissolved in the primitive ocean, concentrated, and underwent polymerization until they formed “coacervate” droplets. The hypothesis was an enormous success, first of all, among the adherents of neo-Darwinism.

The droplets supposedly grew by fusion with other droplets, were split into daughter droplets by the action of tidal waves, and developed the ability to catalyze their own replication, which eventually led to the emergence of life

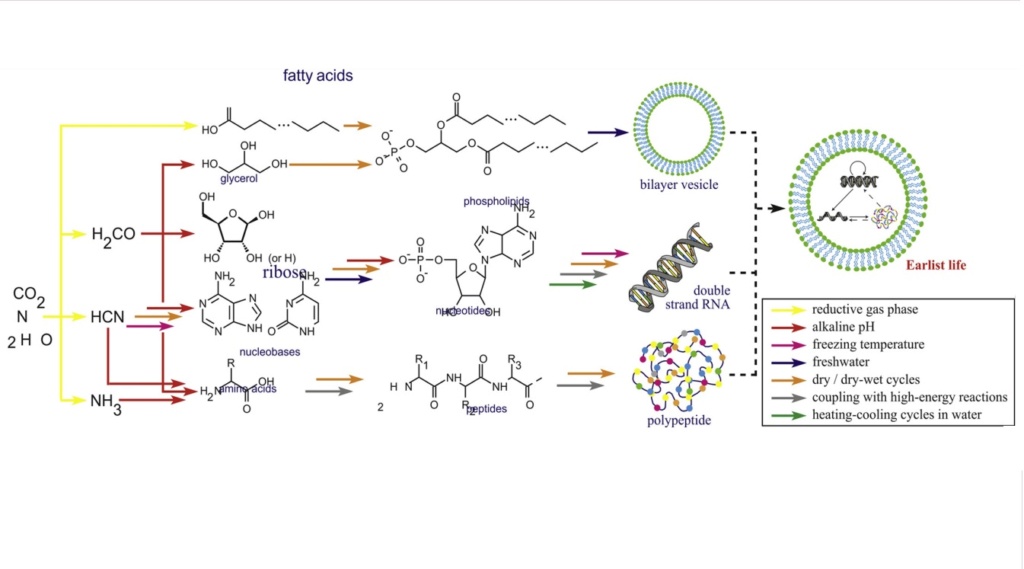
According to the scientific narrative, it is hypothesized that Amino acids emerged on Early earh, between 3.5 and 4 billion years ago, through chemical evolution by chemical synthesis, or better, chemical lucky accidents.

Scientists now recognize twenty-two amino acids as the building blocks of proteins: the twenty common ones and two more, selenocysteine and pyrrolysine.

 The problem of getting nitrogen to make amino acids and DNA on early earth
The problem of getting nitrogen to make amino acids and DNA on early earth 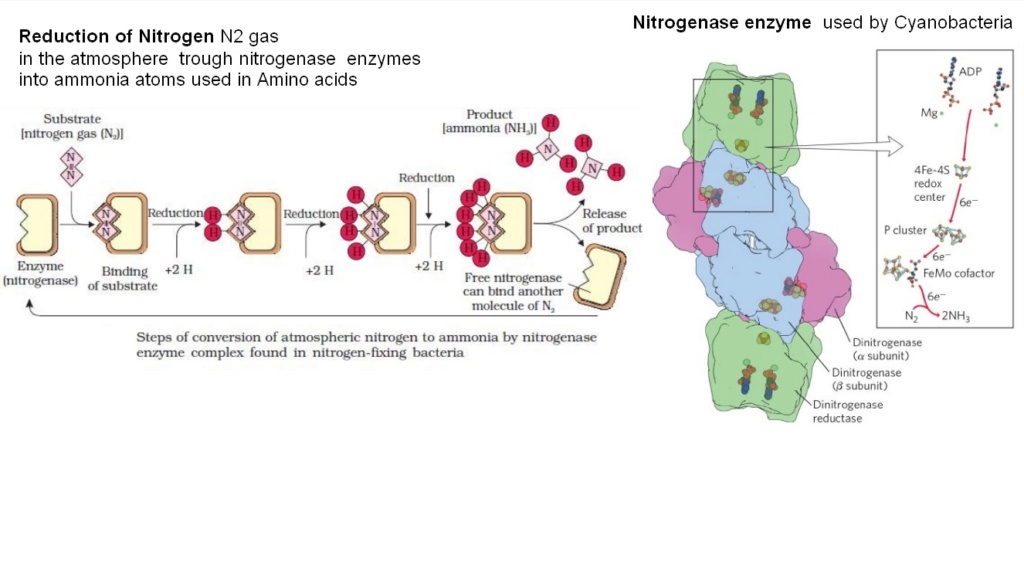
As implied by the word (amine), the essential key atom in amino acid composition is nitrogen, which is included in all enzymes and genes. The ultimate source of nitrogen for the biosynthesis of amino acids is abundant atmospheric nitrogen (N2), a remarkably inert molecule.
Thus, a fundamental problem for biological systems is to obtain nitrogen in a more usable form. This problem is solved by certain microorganisms capable of reducing the inert N = N triple-bond molecule of nitrogen gas to two molecules of ammonia in one of the most amazing reactions in biochemistry.
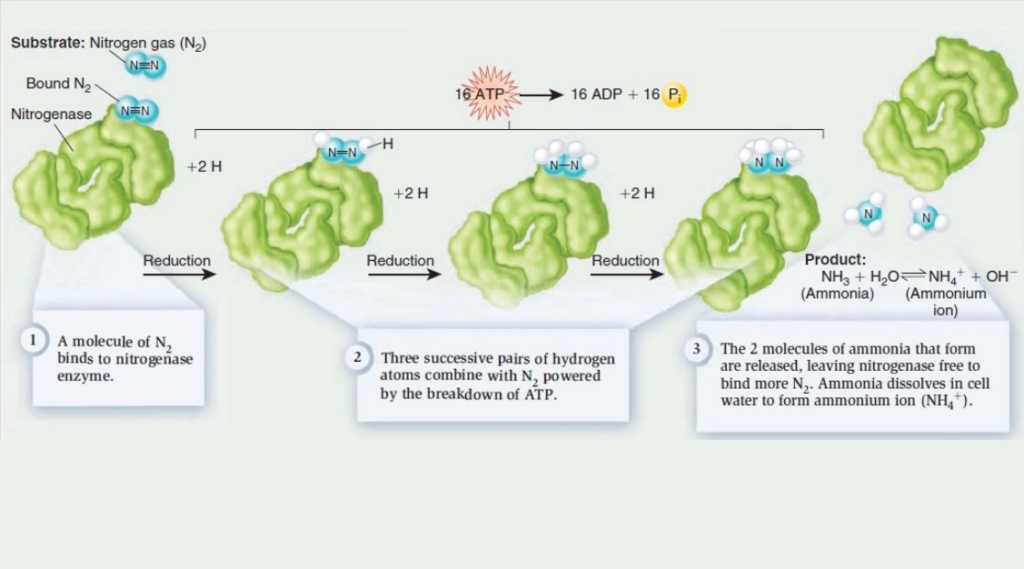
This bond is extremely difficult to break because the three chemical bonds need to be separated and bonded to different compounds. Nitrogenase, a veritable molecular sledgehammer, belongs to the only family of enzymes capable of breaking this bond, carrying out nitrogen fixation. But on early earth, biosynthesis of fixed nitrogen was not available.
For the origin of life, an abiotic source of biochemically accessible nitrogen, especially reduced nitrogen, is necessary. There are proposals as for example UV-driven chemistry which is constructive for synthesizing and activating nucleotides and amino acids, but is destructive for more complex organic systems, such as, for example, DNA strands.
 The problem of getting all amino acids used in llife by origin of life experiments
The problem of getting all amino acids used in llife by origin of life experiments
In 1953, Stanley Miller, a PhD student at the Uni of Chicago, and his supervisor, the Nobel Prize winner Harold Urey, did one of the most famous experiments in our story. They took chemicals that he considered might be present in the atmosphere of the early Earth
They ran water, methane, ammonia, and hydrogen in a sealed flask with a pair of electrodes to produce a spark, and from those simple building blocks discovered that more complex compounds, such as amino acids, were spontaneously produced.
Various biological chemicals were found – glycine ( the simplest amino acid ) plus one of two other chemicals of interest.
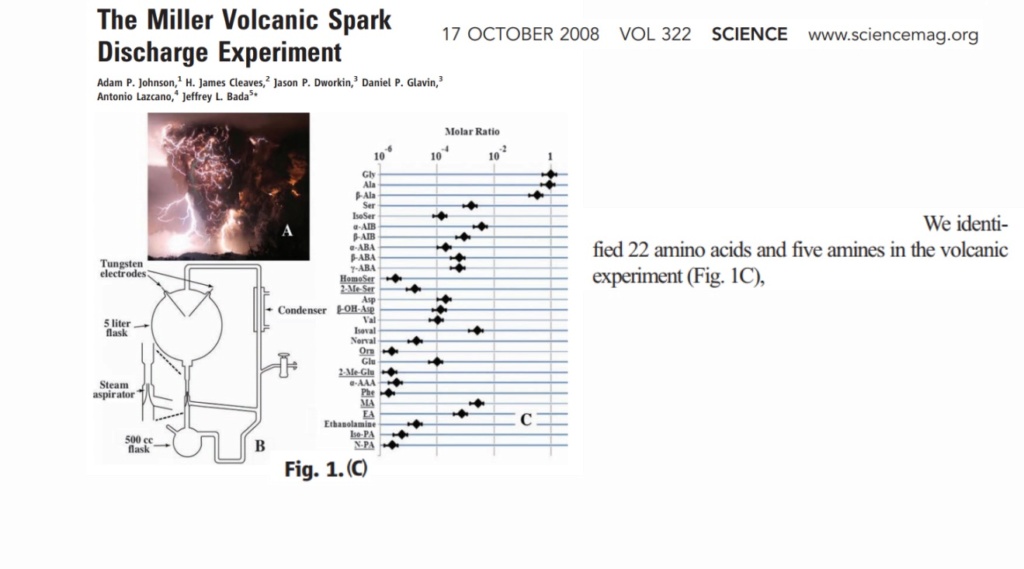
After Millers death in 2007, the so called " volcano in the bottle " experiment was performed, and in total, 22 amino acids were identified.

And the Secular Humanist Society heralded that ALL 20 of the amino acids found in proteins – plus a few others, were produced.
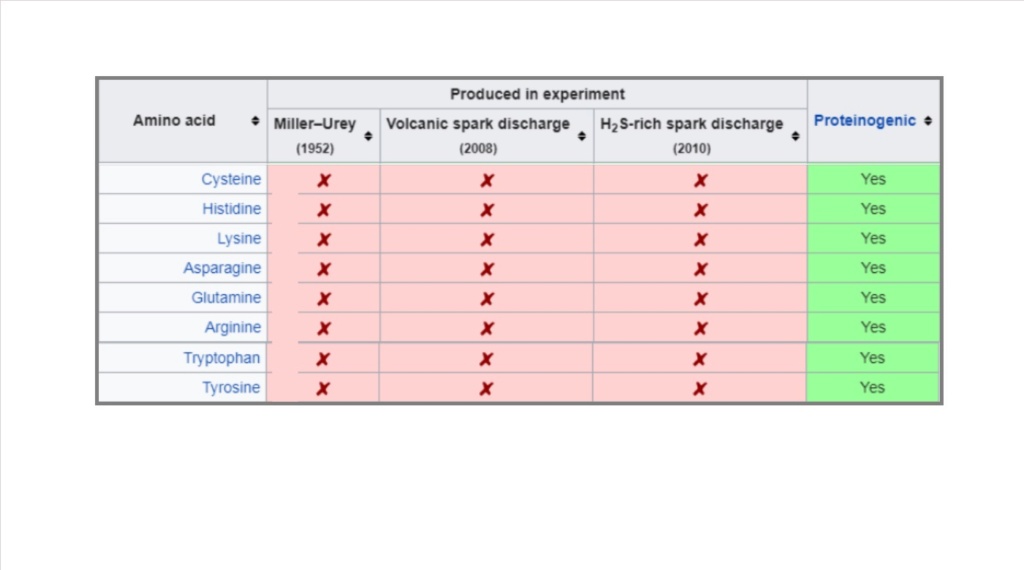
The reanalysis found indeed twenty two amino acids and five amines in the vials. But eight of the proteinogenic amino acids, that is the ones used in living systems, were never produced - in none of the experiments.
Cysteine,
Histidine,
Lysine,
Asparagine,
Glutamine,
Arginine,
Tryptophan,
tyrosine
have not been produced in any miller urey experiment. Nor do they occur naturally on earth

As the building blocks of proteins, amino acids are linked to almost every life process, and as such, essential for life. Amino acids have several functions. Their primary function is to act as the monomer unit in protein synthesis.
 The problem of selecting 20 amino acids prebiotically out of hundreds supposedly existing on early earth.
The problem of selecting 20 amino acids prebiotically out of hundreds supposedly existing on early earth. 
In order to have the amino acids used in life, the twenty right ones amongst over 500 that occur naturally on earth would have had to be selected.

If we suppose that the twenty used in life were ready available, how could that selection process have occured without guidance ? The article above askes : Why did life select just 20 amino acids when 500 occurred naturally on the Hadean Earth ?
That is of course an invalid nonsensical question, since the selection of the right twenty amino acids is a prerequisite for life to start. But also the claim that the 20 used in life were selected amongst 500 naturally occuring amino acids is misleading.

As mentioned previously, eight of the twenty amino acids used in life have never been produced in any laboratory experiment, and aren't either encountered on earth naturally, and neither on meteorites.
 The problem of concentrating the amino acids used in life at one assembly site.
The problem of concentrating the amino acids used in life at one assembly site. Polymer formation in aqueous environments would most likely have been necessary on early Earth because water would have been the reservoir of amino acid precursors needed for protein synthesis.
Polymer formation in aqueous environments would most likely have been necessary on early Earth because water would have been the reservoir of amino acid precursors needed for protein synthesis. The desired reagents would be extremely dilute in the ocean.
And there was no mechanism in existence to concentrate amino acids to one place to start polymerization reactions. But then, even if that hurdle would be overcome, the next problem arises: Careful experiments done in an aqueous solution with very high concentrations of amino acids demonstrate the impossibility of significant polymerization, that is the production of proteins in this environment.
But even worse than that Amino acids tend to fall apart in water, not join.
Even if there were billions of simultaneous trials as the billions of building block molecules interacted in the oceans, or on the thousands of kilometers of shorelines that could provide catalytic surfaces or templates, even if, as is claimed, there was no oxygen in the prebiotic earth, then there would be no protection from UV light, which would destroy and disintegrate prebiotic organic compounds.
A common argument is that amino acids could have been generated in hydrothermal vents, deep in the ocean, far from sunlight. hydrothermal vents could have been the primordial hatcheries of life.

Stanley Miller gave a clear answer: Submarine vents don't make organic compounds, they decompose them.
 The problem of understanding why life uses 20 amino acids, and not more or less.
The problem of understanding why life uses 20 amino acids, and not more or less.
Another relevant question is: Why are these twenty, in some cases, twenty two amino acids used in life, and not another set ?
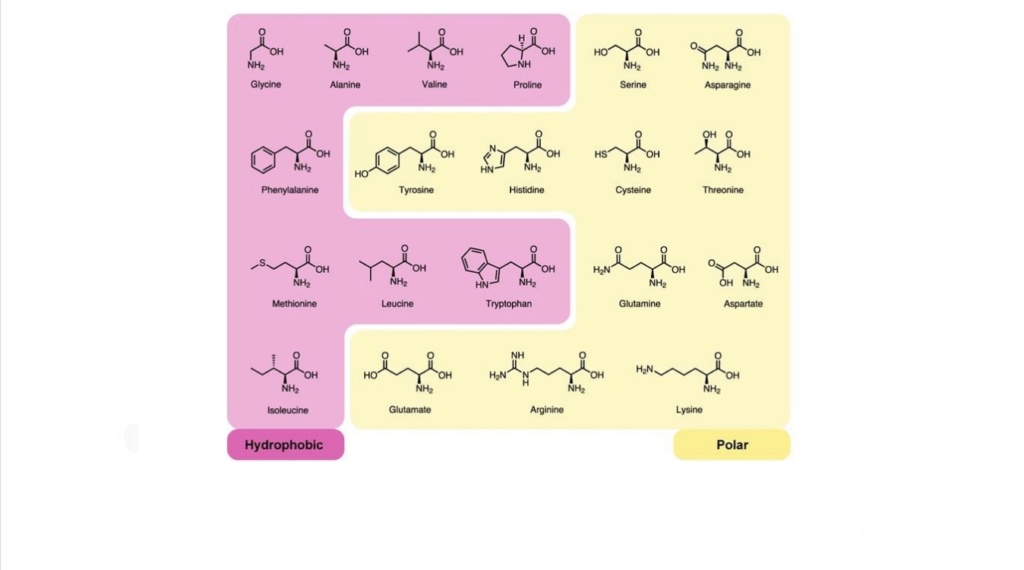
Why 20 and not 10 or 30? And why those particular 20? Forming soluble, stable protein structures with close‐packed cores are
essential to stabilize proteins and to form a rigid structure with well-defined binding sites. and that requires the variety of amino acids used in cells.
A selection of different hydrophobic amino acids permit more options to build a closed protein core and a pocket fit to permit the performance of a variety of enzymatic reactions.
On the other hand, proteins required on the surface for example of cell membranes require straight chains and polar like arginine and glutamic acid.

Scientists have found that the set that is used by biology has a number of surprisingly non-random properties that stand out very clearly.

The paper:
Frozen, but no accident – why the 20 standard amino acids were selected, concluded remarkably: We find that there are excellent REASONS for the selection of every amino acid. Rather than being a frozen accident, the set of amino acidsSELECTED appears to be near ideal. Another paper of Nature magazine Extraordinarily Adaptive Properties of the Genetically Encoded Amino Acids, reported in 2015: We drew one hundred million random sets of 20 amino acids from our library of 1913 structures and compared their coverage of three chemical properties: size, charge, and hydrophobicity, to the standard amino acid alphabet. We measured how often the random sets demonstrated better coverage of chemistry space in one or more, two or more, or all three properties.In doing so, we found that better sets were extremely rare. In fact, when examining all three properties simultaneously, we detected only six sets with better coverage out of the 100 million possibilities tested.That’s quite striking: out of 100 million different sets of twenty amino acids that they measured, only six are better able to explore “chemistry space” than the twenty amino acids that life uses.That suggests that life’s set of amino acids is finely tuned to one part in 16 million.
Another paper of Nature magazine Extraordinarily Adaptive Properties of the Genetically Encoded Amino Acids, reported in 2015: We drew one hundred million random sets of 20 amino acids from our library of 1913 structures and compared their coverage of three chemical properties: size, charge, and hydrophobicity, to the standard amino acid alphabet. We measured how often the random sets demonstrated better coverage of chemistry space in one or more, two or more, or all three properties.In doing so, we found that better sets were extremely rare. In fact, when examining all three properties simultaneously, we detected only six sets with better coverage out of the 100 million possibilities tested.That’s quite striking: out of 100 million different sets of twenty amino acids that they measured, only six are better able to explore “chemistry space” than the twenty amino acids that life uses.That suggests that life’s set of amino acids is finely tuned to one part in 16 million. The problem here is that molecules and an arrangement of correctly selected variety of amino acids would bear no function until life began.
Only a conscient intelligent agent with foresight and reasoning could select for specific distant purposeful goals. Random, unguided events produce only chaotic structures.
Science is absolutely clueless about how the optimal set could have emerged prebiotically and without a guiding hand. The problem of homochirality
The problem of homochirality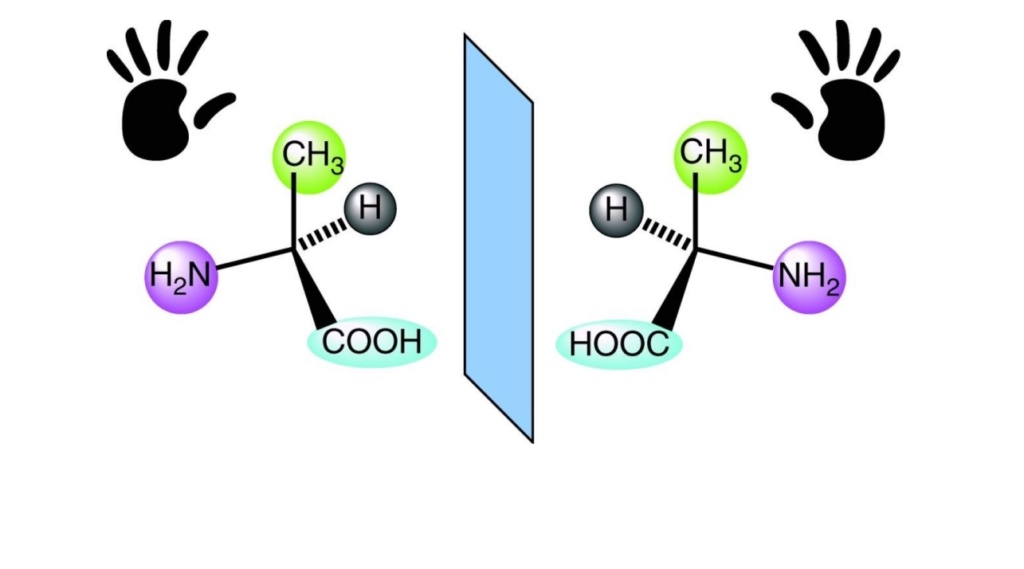 Most molecules of life are homochiral, that is, they possess the same handedness or chirality. Homochirality of biological molecules is a signature of life. The chirality or sense of handedness of the amino acid molecules is an important problem.Figure above shows two versions, one is left handed, the other right handed. Each contains exactly the same number of elements with the same types of chemical bonds, and yet they are the mirror image of each other. A molecule that is not superimposable on its mirror image is called chiral.
Most molecules of life are homochiral, that is, they possess the same handedness or chirality. Homochirality of biological molecules is a signature of life. The chirality or sense of handedness of the amino acid molecules is an important problem.Figure above shows two versions, one is left handed, the other right handed. Each contains exactly the same number of elements with the same types of chemical bonds, and yet they are the mirror image of each other. A molecule that is not superimposable on its mirror image is called chiral.
The handedness of biological molecules such as amino acids or nucleotides plays a role in their functionality. In proteins, only left handed amino acids can be incorporated.  Cells, for instance, use complex molecular protein machines to synthesize amino acids only in left handed form.
Cells, for instance, use complex molecular protein machines to synthesize amino acids only in left handed form.
 In nature, however, amino acids exist in chiral form. That means, both, left and right handed. There was no mechanism to sort them out on early earth, and group only left handed amino acids that then would be used to produce proteins.
In nature, however, amino acids exist in chiral form. That means, both, left and right handed. There was no mechanism to sort them out on early earth, and group only left handed amino acids that then would be used to produce proteins.  The problem of amino acid synthesis regulation
The problem of amino acid synthesis regulation  Biosynthetic pathways in living cells are often highly regulated such that building blocks are synthesized only when supplies are low.Feedback mechanisms ensure that all 20 amino acids are maintained in sufficient amounts for protein synthesis and other processes. Obviously, such regulation did not exist prior the advent of modern cells.
Biosynthetic pathways in living cells are often highly regulated such that building blocks are synthesized only when supplies are low.Feedback mechanisms ensure that all 20 amino acids are maintained in sufficient amounts for protein synthesis and other processes. Obviously, such regulation did not exist prior the advent of modern cells. The problem of peptide bonding of amino acids to form proteins
The problem of peptide bonding of amino acids to form proteins  The formation of amide bonds without the assistance of enzymes poses a major challenge.
The formation of amide bonds without the assistance of enzymes poses a major challenge.
Given an ocean full of small molecules of the types to be produced on pre-biological earth with the types of processes postulated by the origin of life enthusiasts, the next question is about polymerization. There are many different problems confronted by any proposal.  Polypeptides are polymers of amino acids. In other words, many amino acids are chained and linked together via dehydration reactions that form peptide bonds between them. Polymerization is a reaction in which water is a product. Thus it will only be favoured in the absence of water. The presence of precursors in an ocean of water favours depolymerization of any molecules that might be formed.
Polypeptides are polymers of amino acids. In other words, many amino acids are chained and linked together via dehydration reactions that form peptide bonds between them. Polymerization is a reaction in which water is a product. Thus it will only be favoured in the absence of water. The presence of precursors in an ocean of water favours depolymerization of any molecules that might be formed. 
A peer reviewed paper published in 2014 tried to answer the question of prebiotic polymerization on early earth.

To which Evolution News gave ten reasons why the proposals are not sound.

Another problem is the fact that high activation energies are required for amide bond formation, beside the fact that direct peptide bond formation is slow unless high temperature or activating agents are used.

The problem of linking the correct amino acid side-chains together
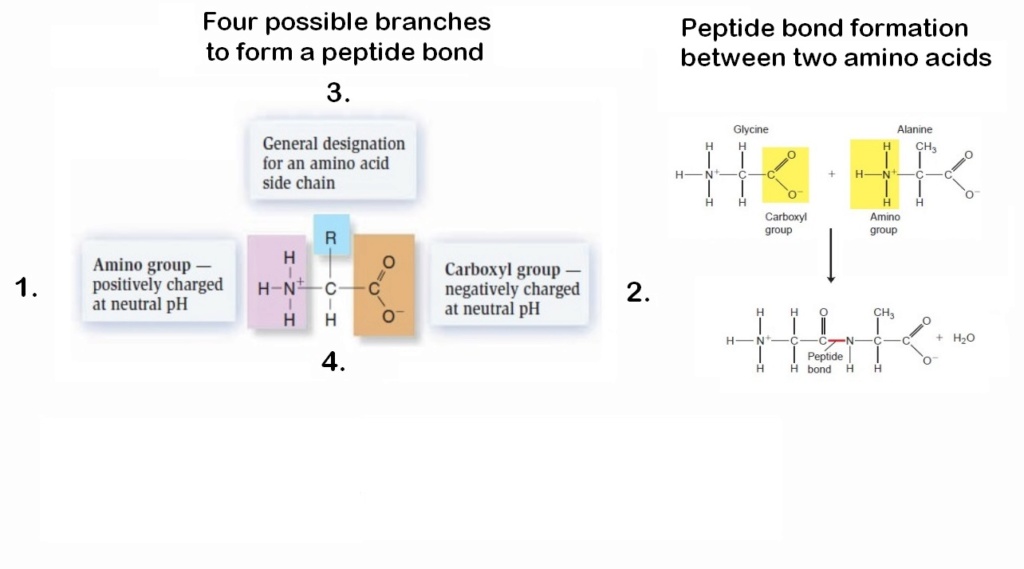
There are four different ways to bond amino acids together by the side chains. Ff bonded to the wrong side chain, no deal.
 Proteins are linear polymers formed by linking the α-carboxyl group of one amino acid to the α-amino group of another amino acid. To form a chain, it is necessary that only bifunctional monomers react together, that is, molecules with two functional groups so they combine with two others.If a unifunctional monomer (with only one functional group) reacts with the end of the chain, the chain can grow no further at this end. If only a small fraction of unifunctional molecules were present, long polymers could not form.But all ‘prebiotic simulation’ experiments produce at least three times more unifunctional molecules than bifunctional molecules.
Proteins are linear polymers formed by linking the α-carboxyl group of one amino acid to the α-amino group of another amino acid. To form a chain, it is necessary that only bifunctional monomers react together, that is, molecules with two functional groups so they combine with two others.If a unifunctional monomer (with only one functional group) reacts with the end of the chain, the chain can grow no further at this end. If only a small fraction of unifunctional molecules were present, long polymers could not form.But all ‘prebiotic simulation’ experiments produce at least three times more unifunctional molecules than bifunctional molecules.
Polymers can adopt various chain structures. Linear, branched, cross-linked, or networked. Proteins are linear homopolymers, while peptide polymers branched. There is no restriction of amino acids bond and form any of the different polimer structures.

But only homopolymerisation permits the formation of functional primary structures used in proteins. Obviously, there was no natural selection of the right formation on the prebiotic earth.
 The problem of linking the right amino acid side-chanis together
The problem of linking the right amino acid side-chanis together
In the same sense as the sequence of alphabetic letters are required to write words, the right sequence of amino acids are required to make functional proteins.
This is truly fascinating: In the same sense as the instructional complex blueprint specifies how to make each gearwheel of a watch, and ultimately, the watch itself, the genetic code instructs the right amino acid sequence to make functional proteins.
If we consider that there were no molecular cell machines to make proteins, no evolution, no mutations nor natural selection prior to functional cells and dna replication, how could the right sequence of a minimal set of at least 500 proteins required for life have been specified, if not by an intelligent agency ?
We only know of intelligence producing instructional information to make machines and factories for specific goals and purposes.
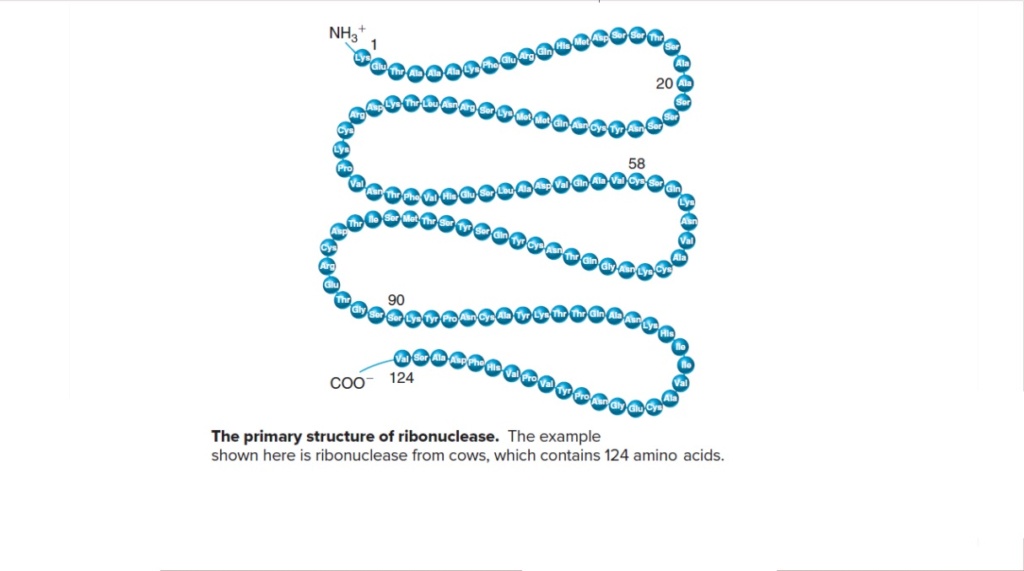
Ribonuclease proteins are found in all domains of life, and it is claimed that they were present in LUCA, the last universal common ancestor of life, and as such, life-essential. They are the simplest RNA proteins, and use 124 amino acids, 19 of the 20 different ones essential for life.
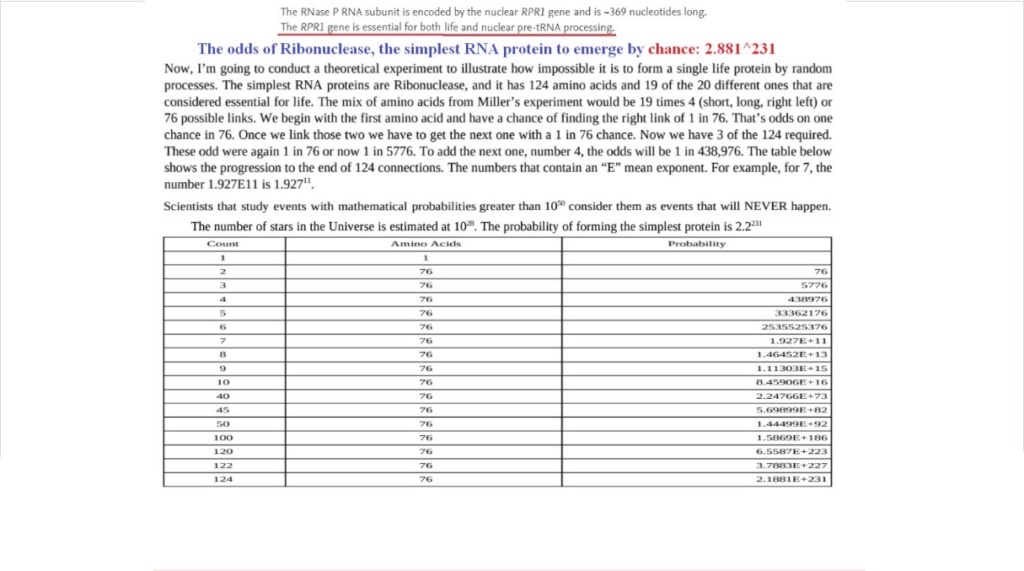
The table demonstrates the catastrophically low probability of getting functional, meaningful amino acid sequences and as consequence, functional proteins, by random, unguided self-assembly spontaneously by orderly aggregation and sequentially correct manner without external direction

Amino acids may be the building blocks of proteins, but there is a world of difference between building blocks and an assembled structure.
 Just as the discovery of a pile of bricks is no guarantee that a house lies around the corner, so a collection of amino acids is a long, long way from the sort of large, specialized molecules such as proteins that life requires.
Just as the discovery of a pile of bricks is no guarantee that a house lies around the corner, so a collection of amino acids is a long, long way from the sort of large, specialized molecules such as proteins that life requires. The problem of getting the right forces that stabilize proteins - essential for their correct folding
The problem of getting the right forces that stabilize proteins - essential for their correct folding Proteins, in order to become functional, must fold into very specific 3D shapes, which happens right when they come out of the Ribosome, where they are synthesized. Specific protein shape and conformation depends on the interactions between its amino acid side chains. For a protein to function it must fold into a resting state which is a complex three-dimensional structure. If a protein fails to fold into its functional structure then it is not only without function but it can become toxic to the cell. As proteins fold, they test a variety of conformations before reaching their final form, which is unique and compact.
Proteins, in order to become functional, must fold into very specific 3D shapes, which happens right when they come out of the Ribosome, where they are synthesized. Specific protein shape and conformation depends on the interactions between its amino acid side chains. For a protein to function it must fold into a resting state which is a complex three-dimensional structure. If a protein fails to fold into its functional structure then it is not only without function but it can become toxic to the cell. As proteins fold, they test a variety of conformations before reaching their final form, which is unique and compact. 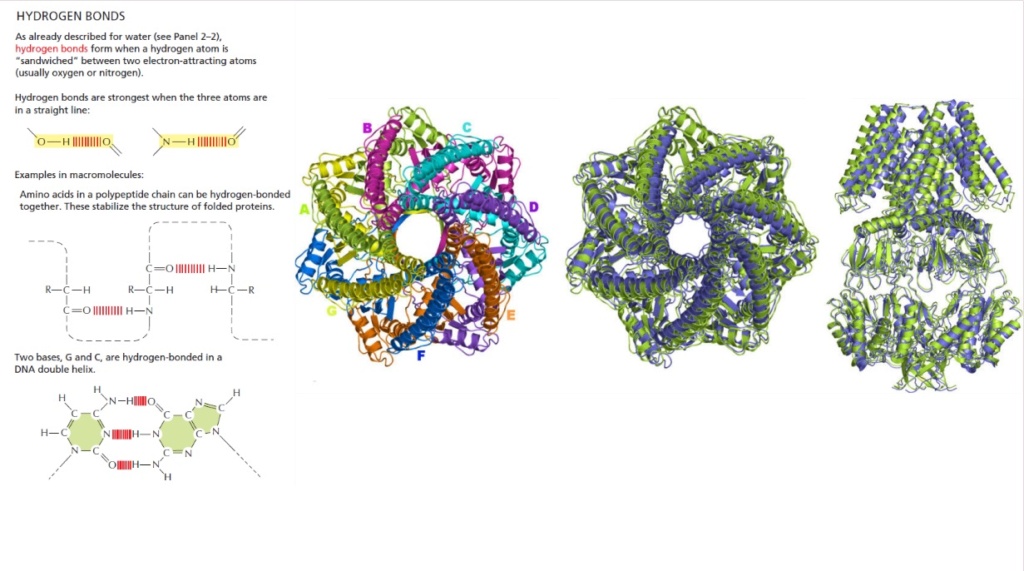 Folded proteins are stabilized by thousands of noncovalent bonds between amino acids. A relatively small protein of only 100 amino acids can take some 10^100 different configurations.If it tried these shapes at the rate of 100 billion a second, it would take longer than the age of the universe to find the correct one. Just how these molecules do the job in nanoseconds, nobody knows.
Folded proteins are stabilized by thousands of noncovalent bonds between amino acids. A relatively small protein of only 100 amino acids can take some 10^100 different configurations.If it tried these shapes at the rate of 100 billion a second, it would take longer than the age of the universe to find the correct one. Just how these molecules do the job in nanoseconds, nobody knows.

The problem of hierarchical structures of proteins
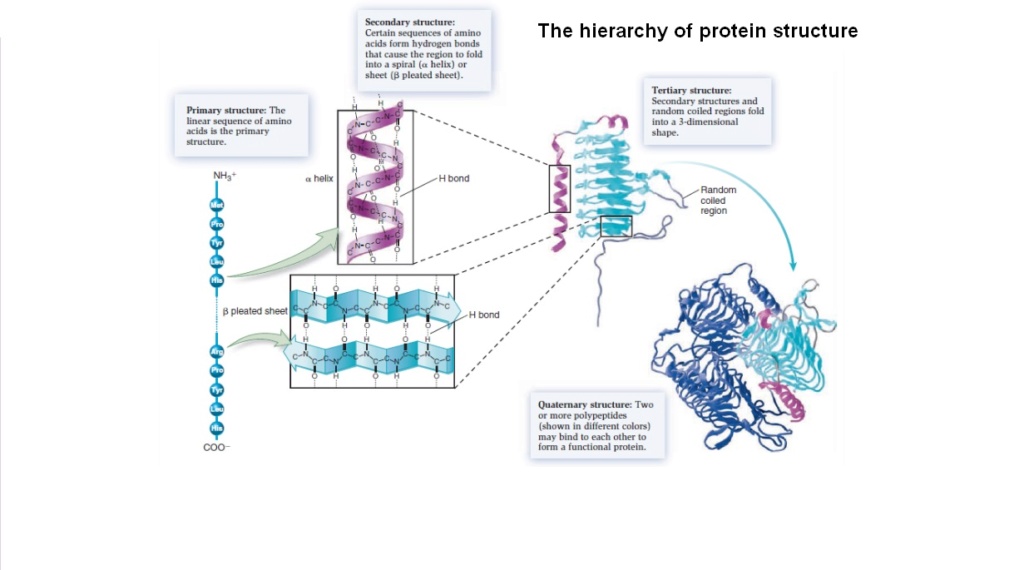 Even if somehow a polypeptide chain in a functional sequence would emerge and fold into a form that later can be useful in the cell, that does not explain how to get to proteins which use not rarely several chains.
Even if somehow a polypeptide chain in a functional sequence would emerge and fold into a form that later can be useful in the cell, that does not explain how to get to proteins which use not rarely several chains. 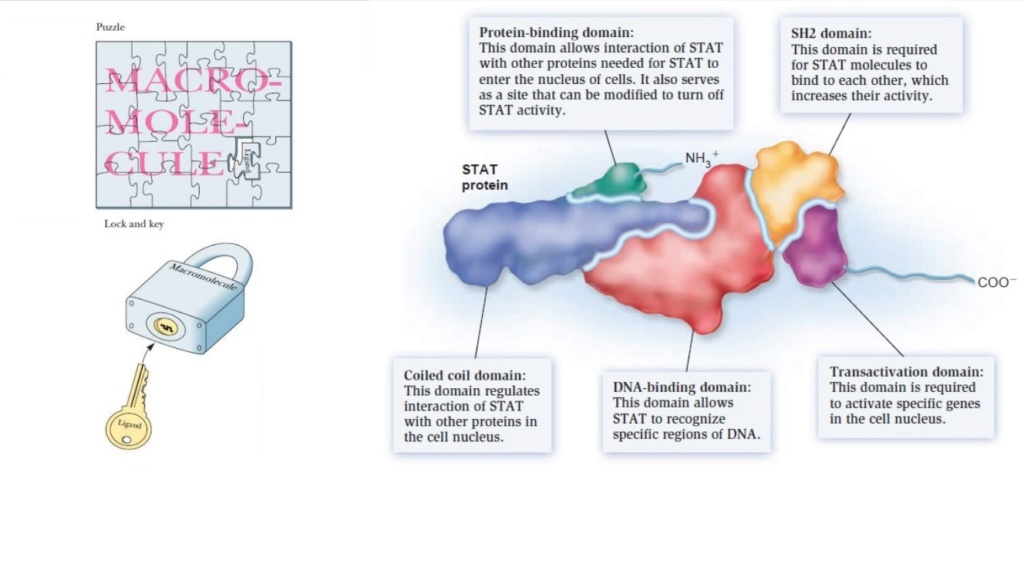
Most proteins become only functional, if they are joined into holo-enzymes, where various amino acid chains come together like lock and key.
Some proteins complexes use over 50 chains or subunits to form a highly complex molecular protein machine. And each subunit must fit precisely to interact correctly with other subunits or protein chains. 
Ribosomes for example which are veritable macromolecular factories, are life essential, and found in all living cells. They are the factory which produce biological protein synthesis by translating the genetic Code, and had to be fully developed when self-replication and life started.

Each ribosome contains around 80 proteins which work together like a various machine parts in a joint venture. It exerts far tighter quality control than anyone ever suspected over its precious protein products. and discarts error-laden proteins 10,000 times faster than it would normally release error-free proteins.
But even IF there would emerge a functional ribosome factory on the early earth, by itself, it would be like a piston outside the engine block of an automobile. Many proteins bear only function once they are integrated in an assembly line, producing sophisticated molecular products used in life.
 To make proteins, and direct and insert them to the right place where they are needed, requires systematic cooperation. At least 25 unimaginably complex biosyntheses and production-line like manufacturing steps are required. Each step requires extremely complex molecular machines composed of numerous subunits and co-factors,, which makes its origin an irreducible catch22 problemIn order for evolution to work, this awe inspiring robot-like working machinery and assembly line must be in place, fully operational. So the origin of this machinery cannot be explained through evolution.All it is left as alternative explanation to intelligent design, are random chemical reactions. Does that make sense ? Now, let's suppose all this would assemble by a freaky random accident on early earth, there would be no mechanism of transition from a prebiotic assembly, to Cell factory synthesis.
To make proteins, and direct and insert them to the right place where they are needed, requires systematic cooperation. At least 25 unimaginably complex biosyntheses and production-line like manufacturing steps are required. Each step requires extremely complex molecular machines composed of numerous subunits and co-factors,, which makes its origin an irreducible catch22 problemIn order for evolution to work, this awe inspiring robot-like working machinery and assembly line must be in place, fully operational. So the origin of this machinery cannot be explained through evolution.All it is left as alternative explanation to intelligent design, are random chemical reactions. Does that make sense ? Now, let's suppose all this would assemble by a freaky random accident on early earth, there would be no mechanism of transition from a prebiotic assembly, to Cell factory synthesis.
Eugene V. Koonin, The Logic of Chance: page 219
The emergence of cells is the epitome of the problems encountered by all explanations of the evolution of complex biological structures. A succession of exceedingly unlikely steps is essential for the origin of life, from the synthesis and accumulation of nucleotides to the origin of translation; through the multiplication of probabilities, these make the final outcome seem almost like a miracle. Among modern biological entities, we do not see any intermediates between macromolecules and cells, and to imagine how such intermediates might operate is a huge challenge.
 Lynn Margulis:To go from a bacterium to people is less of a step than to go from a mixture of amino acids to a bacterium.
Lynn Margulis:To go from a bacterium to people is less of a step than to go from a mixture of amino acids to a bacterium.
Now consider that we have discussed only the prebiotic origin of amino acids and proteins.

There is still the question of how phospholipids emerged to make cell membranes, RNA and DNA to make genes, and carbohydrates to make energy.

And to go from the basic building blocks of life, to a fully self replicating cell, is still a looong way to go.































































