Principais processos de desenvolvimento que moldam a forma e função do organismo
https://elohim.catsboard.com/t375-principais-processos-de-desenvolvimento-que-moldam-a-forma-e-funcao-do-organismo
1. Angiogênese e vasculogênese
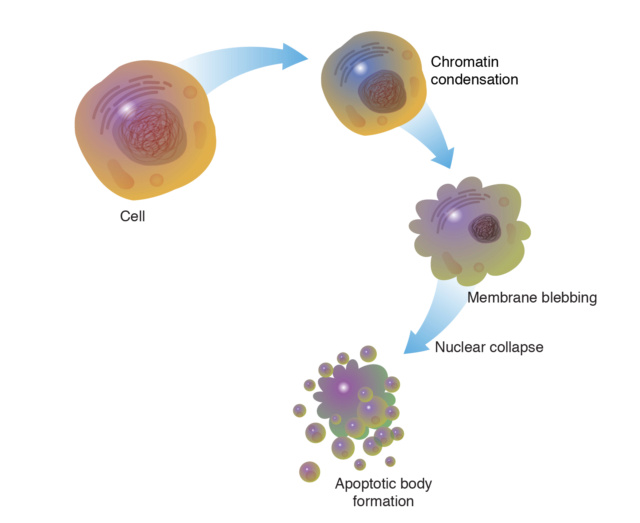
2. Apoptose
3. Regulação do ciclo celular
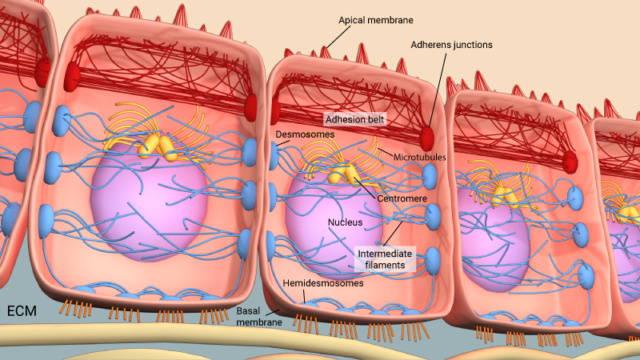
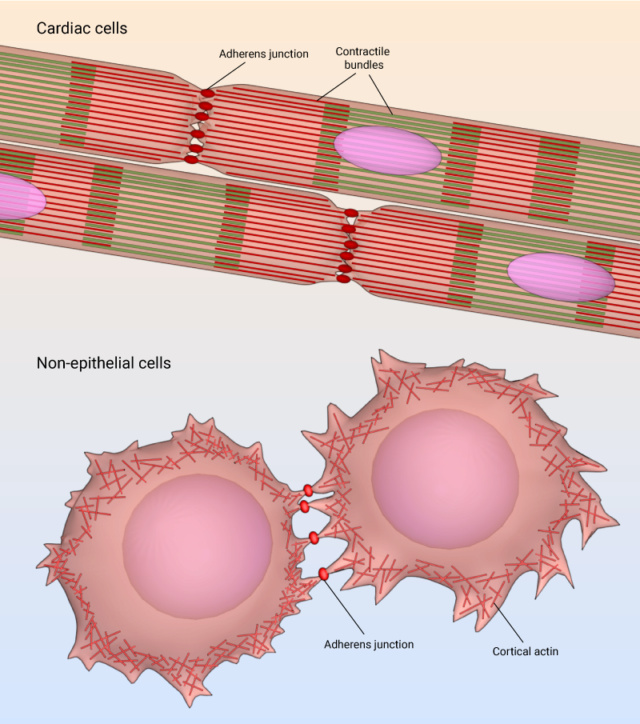
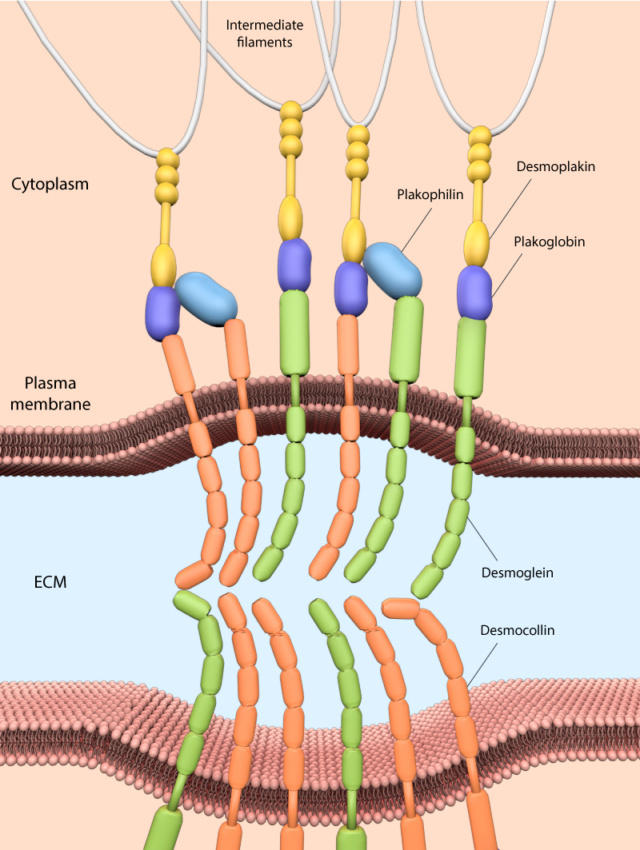
4. Adesão célula-célula e a matriz extracelular (ECM)
5. Comunicação célula-célula
6. Destino celular Determinação e especificação de linhagem
7. Migração celular e quimiotaxia
8. Polaridade e assimetria celular
9. Pluripotência
celular 10. Senescência celular
11. Centrossomos
Dinâmica da cromatina
13. Citocinese
14. Matrizes do citoesqueleto
15. Metilação do DNA
16. Genes de polaridade do ovo
17. Códigos Epigenéticos
18. Rede de Regulação Genética
19. Formação e migração de células germinativas
20. Formação da camada germinativa
21. PTMs de histonas
22. Genes Homeobox e Hox
23. Hormônios
24. Desenvolvimento do sistema imunológico
25. Canais iônicos e campos eletromagnéticos
26. Alvos de membrana
27. Regulação de microRNA
28. Gradientes de morfogênio
29. Morfógenos e Fatores de Crescimento
30. Migração de Células da Crista Neural
31. Poda Neuronal e Sinaptogênese
32. Neurulação e Formação de Tubo Neural
33. RNA Não-codificante de DNA Lixo
34. Maturação e Fertilização de Oócitos
35. Formação de Padrões
36. Segmentação e Somitogênese
40. Vias de Sinalização
41. Regulação e Diferenciação de Células-Tronco
42. Relações Simbióticas e Influência da Microbiota
43. Transposons e Retrotransposons
44. Indução de Tecidos e Organogênese
45. Vascularização e Formação de Vasos Sanguíneos
1. Angiogênese e Vasculogênese
A angiogênese e a vasculogênese são processos essenciais envolvidos na formação e manutenção de vasos sanguíneos nos sistemas biológicos. A angiogênese refere-se à formação de novos vasos sanguíneos a partir dos pré-existentes. Desempenha um papel crucial em vários contextos biológicos, como cicatrização de feridas, regeneração de tecidos e desenvolvimento. A angiogênese produz uma rede de vasos sanguíneos que fornecem nutrientes e oxigênio aos tecidos, removem resíduos e facilitam a troca de moléculas entre a corrente sanguínea e as células circundantes. Este processo é particularmente importante no desenvolvimento embrionário, na reparação e no crescimento de tecidos, bem como em condições como o cancro, onde novos vasos sanguíneos suportam o crescimento do tumor e a metástase. A vasculogênese é o processo pelo qual novos vasos sanguíneos são formados de novo a partir de células progenitoras endoteliais. É particularmente significativo durante o desenvolvimento embrionário, quando o sistema cardiovascular está inicialmente estabelecido. A vasculogênese contribui para a formação do plexo vascular primário, que serve como estrutura para posterior remodelação vascular e o eventual desenvolvimento de uma rede vascular madura. Defeitos na vasculogênese podem levar a graves anormalidades de desenvolvimento. A angiogênese e a vasculogênese são fundamentais para a sobrevivência e função de organismos multicelulares complexos. Eles permitem o transporte eficiente de nutrientes, oxigênio, hormônios e células imunológicas por todo o corpo. Esses processos são vitais para o crescimento, reparo e regeneração dos tecidos, bem como para a manutenção de funções fisiológicas adequadas. Além disso, a angiogênese desempenha um papel em diversas doenças, como câncer, onde a formação excessiva ou aberrante de vasos sanguíneos apoia o crescimento do tumor. A compreensão dos mecanismos moleculares subjacentes à angiogénese e à vasculogénese tem implicações no desenvolvimento de estratégias terapêuticas para condições que envolvem a formação anormal de vasos sanguíneos ou o fornecimento inadequado de sangue aos tecidos.
Aparecimento da angiogênese e da vasculogênese na linha do tempo evolutiva
O aparecimento da angiogênese e da vasculogênese na linha do tempo evolutiva é um tópico complexo que envolve especulação e pesquisas contínuas. Embora o momento exacto não seja definitivamente conhecido, os cientistas propuseram hipóteses sobre quando estes processos poderão ter surgido com base em estudos comparativos e no registo fóssil. A angiogênese e a vasculogênese são processos fundamentais para o desenvolvimento e manutenção dos vasos sanguíneos nos organismos. A angiogênese envolve a formação de novos vasos sanguíneos a partir de vasos pré-existentes, enquanto a vasculogênese se refere à formação de novo de vasos sanguíneos a partir de células precursoras endoteliais.
Formas de vida precoce (procariontes):Esses organismos simples provavelmente não possuíam sistemas vasculares complexos ou mecanismos como angiogênese e vasculogênese. A troca de nutrientes e a remoção de resíduos foram provavelmente facilitadas pela difusão direta através das membranas celulares devido ao seu pequeno tamanho e estrutura relativamente simples.
Eucariontes Simples: À medida que os organismos evoluíram para formas eucarióticas mais complexas, alguns organismos multicelulares começaram a desenvolver mecanismos básicos para transportar nutrientes e resíduos. No entanto, os verdadeiros sistemas vasculares ainda não haviam surgido, e mecanismos como a difusão e a simples organização dos tecidos serviram a esses primeiros organismos.
Invertebrados:O aparecimento de invertebrados mais complexos marcou a transição para sistemas circulatórios mais desenvolvidos. Muitos invertebrados possuem sistemas circulatórios abertos onde o sangue é bombeado para as cavidades corporais, permitindo a troca de nutrientes. Esses sistemas podem ter envolvido processos precursores rudimentares que poderiam ser considerados formas primitivas de angiogênese.
Vertebrados: O surgimento dos vertebrados trouxe sistemas circulatórios mais sofisticados, incluindo sistemas fechados com vasos sanguíneos dedicados. Embora o ponto exato em que a angiogênese e a vasculogênese evoluíram na história dos vertebrados não seja claro, elas provavelmente desempenharam papéis essenciais no desenvolvimento de sistemas vasculares mais avançados.
Primeiros vertebrados:Com o tempo, os vertebrados desenvolveram sistemas cardiovasculares cada vez mais complexos. O surgimento da angiogênese e da vasculogênese poderia ter acompanhado a necessidade de fornecimento mais eficiente de nutrientes, remoção de resíduos e reparo tecidual. Esses processos teriam permitido aos vertebrados sustentar corpos maiores e mais metabolicamente ativos.
Informação Genética De Novo, necessária para instanciar a angiogênese e a vasculogênese
O hipotético surgimento da angiogênese, o processo de formação de novos vasos sanguíneos a partir do zero no desenvolvimento de organismos que anteriormente não possuíam sistema vascular, teria exigido a adição de informações genéticas específicas para possibilitar esse processo complexo. Embora as alterações genéticas exatas sejam especulativas, aqui estão algumas adições ou modificações potenciais na informação genética que poderiam estar envolvidas na evolução da angiogênese:
Fatores Angiogênicos: O desenvolvimento da angiogênese a partir do zero teria exigido a evolução de genes que codificam fatores angiogênicos, como como versões rudimentares de fatores de crescimento endotelial vascular (VEGFs). Esses fatores atuariam como moléculas sinalizadoras para iniciar a formação de vasos.
Proteínas Receptoras:O surgimento da angiogênese teria exigido o desenvolvimento de novas proteínas receptoras em hipotéticas células precursoras do tipo endotelial. Estes receptores permitiriam que as células detectassem e respondessem a factores angiogénicos, iniciando as cascatas de sinalização necessárias para a formação de vasos.
Moléculas de adesão celular: À medida que as células começam a se organizar em vasos sanguíneos, novas informações genéticas podem ter sido necessárias para gerar moléculas primitivas de adesão celular. Essas moléculas facilitariam as interações célula-célula e a formação de estruturas semelhantes a vasos.
Enzimas de remodelação de matriz: A formação inicial de vasos sanguíneos a partir do zero envolveria a quebra e a reestruturação da matriz extracelular. Os genes que codificam enzimas de remodelação da matriz poderiam ter evoluído para permitir que as células criassem caminhos para o crescimento dos vasos.
Fatores de Transcrição: A evolução da angiogênese exigiria novos fatores de transcrição que ativassem programas de expressão gênica específicos para a formação de vasos. Esses fatores regulariam a expressão de genes envolvidos na migração, proliferação e diferenciação celular.
Proteínas de orientação: Para direcionar o movimento das células primitivas do tipo endotelial em direção à formação de vasos sanguíneos, hipotéticas proteínas de orientação poderiam ter evoluído para fornecer sinais direcionais.
Moléculas e vias de sinalização: Novas informações genéticas seriam necessárias para estabelecer as vias de sinalização iniciais que desencadeiam respostas celulares, como migração, proliferação e diferenciação, durante a angiogênese.
Reguladores do citoesqueleto: O desenvolvimento da angiogênese a partir do zero exigiria genes que controlassem a dinâmica do citoesqueleto, permitindo o movimento, a migração e a organização das células em estruturas semelhantes a vasos.
Reguladores de apoptose e sobrevivência: À medida que as células formam vasos sanguíneos, os mecanismos para equilibrar a sobrevivência celular e a morte celular seriam cruciais. Genes envolvidos na apoptose e nas vias de sobrevivência podem ter sido necessários.
Genes de Diferenciação e Especificação: A evolução da angiogênese envolveria o desenvolvimento de genes que especificam e diferenciam células precursoras em células do tipo endotelial com papéis distintos na formação de vasos.
Moléculas de comunicação célula-célula: Novas informações genéticas poderiam ter sido necessárias para permitir que as células se comunicassem e coordenassem seus comportamentos durante a formação dos vasos sanguíneos.
Vias de sinalização celular para coordenação: Para garantir a coordenação adequada entre células semelhantes ao endotélio, a informação genética pode ter evoluído para criar vias rudimentares de sinalização celular para comunicação e sincronização.
Mecanismos reguladores epigenéticos necessários para serem instanciados
O hipotético surgimento da angiogênese “do zero”, ou seja, a evolução da formação de vasos sanguíneos em organismos que anteriormente não possuíam tal sistema, teria exigido o estabelecimento de novas regulamentações epigenéticas para coordenar as complexas alterações celulares necessárias para o desenvolvimento dos vasos.
Preparação Epigenética para Precursores Vasculares: O passo inicial pode ter envolvido o estabelecimento de marcas epigenéticas que preparam certas células precursoras para a diferenciação vascular. Essas marcas poderiam criar um ambiente de cromatina permissivo para genes relacionados à angiogênese.
Modificações de histonas para formação de vasos:A evolução da angiogênese teria exigido o surgimento de modificações específicas de histonas que ativam genes envolvidos no desenvolvimento dos vasos. A acetilação de histonas, por exemplo, poderia aumentar a expressão de genes relacionados à diferenciação endotelial e à formação de tubos.
Dinâmica de metilação do DNA: A formação de vasos sanguíneos exigiria o estabelecimento de padrões específicos de metilação do DNA. Novos padrões poderiam regular a expressão de genes essenciais para a angiogênese, ajustando sua ativação durante diferentes estágios de formação de vasos.
Regulação mediada por RNA não codificante:A evolução da angiogênese pode ter levado ao surgimento de RNAs não codificantes, como microRNAs ou RNAs não codificantes longos, que poderiam interagir com complexos modificadores da cromatina para regular a expressão de genes associados ao desenvolvimento de vasos.
Impressão e regulação alélica: Para garantir a montagem adequada dos vasos, a evolução da angiogênese poderia envolver o estabelecimento de marcas epigenéticas específicas de alelos que orientam as células a adotarem papéis específicos durante a formação dos vasos.
Herança Epigenética de Padrões Vasculares: A capacidade de transmitir informações epigenéticas relacionadas à formação de vasos poderia ter evoluído, permitindo que as gerações subsequentes herdassem as marcas regulatórias necessárias para a angiogênese.
Regulamentos Epigenéticos Temporais:O desenvolvimento coordenado da angiogênese exigiria a evolução de mecanismos epigenéticos que atuassem como “relógios” moleculares, garantindo o tempo preciso dos processos relacionados aos vasos.
Supressão de Fatores Antiangiogênicos: Novas regulamentações epigenéticas poderiam ter evoluído para suprimir a expressão de genes que codificam fatores antiangiogênicos, garantindo que o processo de desenvolvimento dos vasos não fosse prejudicado.
Remodelação da cromatina para montagem de vasos: À medida que células semelhantes ao endotélio se unem para formar vasos, novos mecanismos epigenéticos podem ter sido necessários para regular a remodelação da cromatina, facilitando as interações célula-célula adequadas e a formação de tubos.
Regulação Epigenética da Maturação Vascular:Marcas epigenéticas podem ter sido necessárias para orientar a maturação e estabilização dos vasos recém-formados, incluindo o recrutamento de células de suporte como pericitos e células musculares lisas.
Detecção Epigenética de Sinais Ambientais: A evolução da angiogênese provavelmente exigiria mecanismos epigenéticos que permitissem às células detectar e responder aos sinais ambientais, permitindo a formação adaptativa de vasos em diferentes contextos.
Vias de sinalização necessárias para criar e manter a angiogênese e a vasculogênese
Se considerarmos o surgimento da angiogênese "do zero", ou seja, o desenvolvimento inicial do processo em organismos que anteriormente não possuíam nenhum sistema vascular, possíveis vias de sinalização que teriam que estar envolvidas na evolução hipotética da angiogênese : são:
Fator Básico de Crescimento e Vias Receptoras: O surgimento da angiogênese teria exigido a evolução de vias básicas de fatores de crescimento e sistemas receptores que estimulam a proliferação, migração e diferenciação celular. Cascatas de sinalização simples envolvendo ligantes e receptores podem ter formado a base para uma sinalização angiogênica mais complexa.
Caminhos de quimiotaxia:Hipoteticamente, as vias rudimentares de sinalização quimiotática poderiam ter evoluído para guiar células primitivas do tipo endotelial em direção a gradientes específicos de fatores que promovem o movimento celular. Estas poderiam ter sido versões primitivas de caminhos de desenvolvimento posterior.
Vias de adesão: A angiogênese precoce teria exigido adesão e migração celular. As vias de sinalização relacionadas às moléculas de adesão celular poderiam ter surgido para facilitar o movimento e a organização das células endoteliais em vasos sanguíneos nascentes.
Vias de remodelação do citoesqueleto: A evolução da angiogênese provavelmente teria envolvido mecanismos para alterar a forma e o movimento celular. As vias de sinalização relacionadas ao citoesqueleto, como a dinâmica da actina e dos microtúbulos, poderiam ter sido essenciais.
Vias de comunicação célula-célula: Vias básicas de comunicação célula-célula podem ter se desenvolvido para permitir que células endoteliais primitivas coordenassem seus comportamentos durante os estágios iniciais da formação de vasos.
Apoptose e vias de sobrevivência: Como a formação de vasos requer o equilíbrio preciso entre a morte celular (apoptose) e a sobrevivência celular, vias hipotéticas que regulam estes processos podem ter sido cruciais.
Sinalização inicial da matriz extracelular: As vias de sinalização envolvidas na resposta ao ambiente extracelular poderiam ter surgido para guiar as células para formar estruturas semelhantes ao precursor rudimentar dos vasos sanguíneos.
Evolução dos pares ligante-receptor:Novos pares ligante-receptor podem ter evoluído, permitindo que as células detectem e respondam aos sinais que promovem a formação de vasos.
O surgimento da angiogênese, o processo de formação de novos vasos sanguíneos a partir de vasos pré-existentes, teria envolvido o estabelecimento e a modificação de vias de sinalização específicas para coordenar as complexas alterações celulares necessárias para a formação de vasos. Embora as vias de sinalização exatas sejam especulativas, aqui estão algumas vias potenciais que poderiam estar envolvidas no surgimento da angiogênese:
Via de sinalização do VEGF:O fator de crescimento endotelial vascular (VEGF) é um regulador central da angiogênese. A via de sinalização do VEGF envolve a ligação do VEGF aos seus receptores (VEGFRs) nas células endoteliais. Isso ativa cascatas de sinalização a jusante que promovem a proliferação, migração e formação de tubos de células endoteliais.
Via de sinalização FGF: Fatores de crescimento de fibroblastos (FGFs) também desempenham um papel na angiogênese. A via de sinalização do FGF, semelhante à via do VEGF, envolve a ligação dos ligantes do FGF aos seus receptores, o que desencadeia eventos de sinalização que contribuem para a proliferação e migração das células endoteliais.
Caminho de sinalização de entalhe:A via Notch está envolvida na comunicação célula-célula e poderia ter desempenhado um papel na coordenação da diferenciação das células endoteliais e na seleção das células da ponta durante o surgimento dos vasos.
Via de sinalização Wnt: A via Wnt tem diversas funções no desenvolvimento, e seus componentes podem estar envolvidos na angiogênese, influenciando o comportamento das células endoteliais e os padrões de ramificação dos vasos.
Via de sinalização TGF-β: Os membros da família do fator de crescimento transformador beta (TGF-β) poderiam ter sido implicados na angiogênese, regulando a diferenciação de células endoteliais e a remodelação da matriz extracelular.
Caminho de sinalização PDGF:A sinalização do fator de crescimento derivado de plaquetas (PDGF) pode estar envolvida no recrutamento de pericitos e células musculares lisas para estabilizar e amadurecer vasos recém-formados.
Vias de sinalização da MEC: Os componentes da matriz extracelular (MEC), incluindo integrinas e quinase de adesão focal (FAK), poderiam ter participado na transmissão de sinais que orientam a migração de células endoteliais e a montagem de vasos.
Via de sinalização MAPK: As vias da proteína quinase ativada por mitógeno (MAPK) poderiam ter sido essenciais para a transmissão de sinais que regulam a proliferação, sobrevivência e migração celular durante a angiogênese.
Caminho de sinalização PI3K/AKT:A via fosfatidilinositol 3-quinase (PI3K)/AKT poderia estar envolvida na promoção da sobrevivência das células endoteliais, migração e respostas celulares relacionadas à angiogênese.
Via de sinalização Rho GTPase: Rho GTPases, como Rho, Rac e Cdc42, poderiam ter participado na regulação da dinâmica do citoesqueleto e na migração celular durante a angiogênese.
Sinalização de quimiocinas: As quimiocinas e seus receptores podem ter guiado a migração e o posicionamento das células endoteliais durante o surgimento dos vasos.
Via de sinalização Hedgehog: A sinalização Hedgehog pode ter sido implicada na regulação do padrão vascular e na diferenciação de células endoteliais.
Vias de sinalização específicas do endotélio:As vias de sinalização especificamente ativas nas células endoteliais poderiam ter evoluído para controlar processos relacionados à angiogênese, como proliferação, migração e formação de tubos.
Códigos reguladores necessários para manutenção e operação
O hipotético surgimento de vasos sanguíneos e da angiogênese provavelmente envolveria o estabelecimento de códigos e linguagens reguladoras para coordenar o desenvolvimento, manutenção e operação do sistema vascular. Embora os detalhes exatos sejam especulativos, aqui estão possíveis códigos regulatórios e linguagens que poderiam ter sido instanciados:
Código Regulatório Transcricional:A evolução dos vasos sanguíneos exigiria um código regulador transcricional envolvendo sequências específicas de DNA, fatores de transcrição e elementos reguladores que controlam a expressão de genes envolvidos no desenvolvimento, manutenção e função dos vasos.
Elementos reguladores cis: Intensificadores, promotores e outros elementos reguladores cis precisariam evoluir para garantir a expressão espaço-temporal adequada de genes relacionados à angiogênese.
Linguagem Reguladora Epigenética: Modificações epigenéticas, como metilação do DNA e modificações de histonas, poderiam formar uma linguagem reguladora epigenética que orienta a ativação e repressão de genes essenciais para o desenvolvimento e manutenção vascular.
Crosstalk da via de sinalização:As vias de sinalização complexas envolvidas na angiogénese e na função vascular precisariam de comunicar e coordenar as suas actividades através de uma linguagem reguladora que assegurasse respostas celulares adequadas.
Códigos de comunicação célula-célula: Como os vasos sanguíneos envolvem vários tipos de células, seria necessário um código de comunicação envolvendo receptores de superfície celular, ligantes e suas interações para coordenar comportamentos e funções celulares.
Sinalização da Matriz Extracelular (MEC): Um código envolvendo interações entre as células e a matriz extracelular regularia processos como adesão, migração e sinalização celular.
Código de Padronização Vascular:O estabelecimento de redes hierárquicas de vasos exigiria um código que orientasse a formação e os padrões de ramificação dos vasos sanguíneos para garantir a distribuição eficiente de nutrientes e oxigênio.
Código de Estabilidade e Maturação: A estabilização e maturação dos vasos sanguíneos exigiria um código regulatório envolvendo a comunicação entre as células endoteliais e as células de suporte (pericitos e células musculares lisas) para garantir a integridade estrutural.
Código de detecção de oxigênio e nutrientes: Os vasos sanguíneos precisam se adaptar às mudanças nos níveis de oxigênio e nutrientes. Um código regulador poderia reger a resposta dos navios a estas flutuações, garantindo a dilatação e constrição apropriada dos vasos.
Comunicação Imuno-Endotelial:Os vasos sanguíneos interagem com o sistema imunológico. Seria necessário um código para regular a comunicação entre as células endoteliais e as células do sistema imunológico, permitindo a vigilância imunológica e a regulação da inflamação.
Código de resposta inflamatória: As respostas inflamatórias e os processos de reparação exigiriam um código regulador para ativar e controlar genes específicos envolvidos na reparação de tecidos e na remodelação dos vasos.
Código de tônus vascular e homeostase: A pressão arterial e o tônus dos vasos precisam ser rigorosamente regulados. Seria necessário um código para equilibrar a vasoconstrição e a vasodilatação para manter o fluxo sanguíneo e a homeostase.
Código de troca angiogênica:A transição dos vasos quiescentes para a ativação da angiogênese exigiria um código que detectasse sinais ambientais e desencadeasse respostas angiogênicas.
Código de regressão vascular: os vasos precisam regredir quando não são necessários. Um código regulatório seria necessário para iniciar a regressão dos vasos e a remodelação dos tecidos.
Código de cicatrização e regeneração de feridas: Os vasos sanguíneos desempenham um papel na reparação de tecidos. Um código estaria envolvido na coordenação dos processos relacionados aos vasos durante a cicatrização de feridas e regeneração de tecidos.
Esses códigos e linguagens reguladoras teriam que surgir para garantir o desenvolvimento, a manutenção e a operação dos vasos sanguíneos. Os detalhes precisos dependeriam do contexto específico e dos mecanismos genéticos e moleculares que contribuíram para o surgimento da angiogênese e dos sistemas vasculares. Diferenças entre Angiogênese e Vasculogênese A vasculogênese e a angiogênese são dois processos distintos, mas interconectados, envolvidos na formação e desenvolvimento de vasos sanguíneos dentro de um organismo. Embora partilhem semelhanças, diferem no momento, nos mecanismos e nos contextos. Vasculogênese
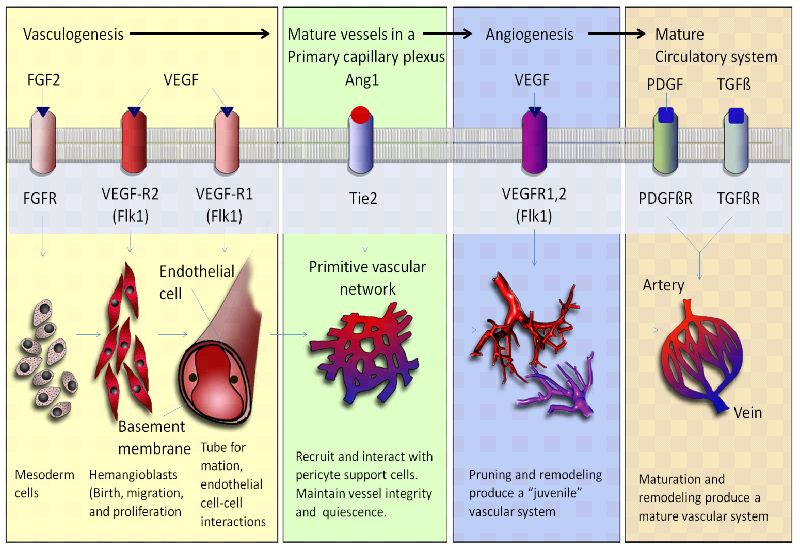
A vasculogênese é o processo pelo qual novos vasos sanguíneos são formados de novo (do zero) durante o desenvolvimento embrionário. Ocorre principalmente durante os estágios iniciais da embriogênese, quando o embrião é um aglomerado de células indiferenciadas. Aqui estão as principais diferenças:
Momento: A vasculogênese ocorre muito cedo no desenvolvimento embrionário, muitas vezes antes da formação dos órgãos principais. Envolve a montagem inicial da rede vascular primária.
Origem celular: Durante a vasculogênese, as células precursoras endoteliais, chamadas angioblastos, diferenciam-se das células mesodérmicas. Esses angioblastos agregam-se e coalescem para formar os vasos sanguíneos primitivos.
Organogênese:A vasculogênese está intimamente associada à organogênese. À medida que os órgãos começam a se desenvolver, a rede vascular primária formada pela vasculogênese fornece a base para o subsequente crescimento e desenvolvimento dos órgãos.
Formação de vasos: Na vasculogênese, os angioblastos se agregam para formar estruturas semelhantes a vasos sanguíneos, que então se unem para criar o plexo capilar primário. Este processo envolve a diferenciação e a organização das células endoteliais em estruturas semelhantes a vasos.
Angiogênese
A angiogênese é o processo de formação de novos vasos sanguíneos a partir de vasos pré-existentes. É um processo mais refinado e especializado que ocorre durante vários estágios de desenvolvimento e em resposta a necessidades específicas do corpo. Aqui estão as principais diferenças:
Tempo:A angiogênese pode ocorrer durante o desenvolvimento embrionário e nos estágios pós-natais. Desempenha um papel no crescimento dos tecidos, na cicatrização de feridas e em outros processos ao longo da vida de um organismo.
Origem Celular: Durante a angiogênese, as células endoteliais existentes em vasos sanguíneos preexistentes são ativadas para proliferar, migrar e remodelar, formando novos vasos sanguíneos. Envolve a expansão e remodelação das redes vasculares existentes.
Crescimento e reparo de tecidos: A angiogênese é essencial para o crescimento, reparo e regeneração de tecidos. Permite a expansão da rede vascular para fornecer nutrientes e oxigênio aos tecidos em crescimento ou para auxiliar na cicatrização de tecidos feridos.
Iniciação:A angiogênese é iniciada em resposta a sinais específicos, como hipóxia (baixos níveis de oxigênio) ou fatores de crescimento liberados durante lesão tecidual. Esses sinais ativam as células endoteliais nos vasos existentes para brotar, migrar e formar novos vasos.
Existem evidências científicas que apoiam a ideia de que estes sistemas biológicos foram criados pelo processo de evolução?
Interdependência Funcional: A angiogênese e a vasculogênese envolvem múltiplas etapas interdependentes, incluindo migração celular, proliferação, sinalização e remodelação da MEC. É um desafio imaginar como cada etapa poderia evoluir de forma independente, já que muitos componentes são necessários para que o processo seja funcional.
Redes de Sinalização Complexas:A formação bem sucedida de vasos sanguíneos requer uma coordenação precisa de múltiplas vias de sinalização. Essas vias envolvem interações intrincadas entre fatores de crescimento, moléculas de adesão celular e fatores de transcrição. Para que a angiogênese e a vasculogênese funcionem, essas vias precisam estar instaladas e funcionais simultaneamente.
Estruturas Necessárias: Os vasos sanguíneos requerem uma certa complexidade estrutural para funcionar adequadamente. Os vasos precisam ser capazes de transportar o sangue de forma eficiente, resistir às forças mecânicas e manter as propriedades de barreira. Estes requisitos estruturais tornam improvável que navios parcialmente desenvolvidos ou em fases intermédias proporcionem qualquer vantagem selectiva.
Custos de energia e recursos:O desenvolvimento e a manutenção dos vasos sanguíneos são metabolicamente dispendiosos. A evolução exige que os estágios intermediários ofereçam alguma vantagem seletiva ao organismo. Se os estágios intermediários carecem de funcionalidade e incorrem apenas em custos de energia e recursos, é menos provável que sejam favorecidos pela seleção natural.
Regulação e Controle: Os processos de angiogênese e vasculogênese precisam ser rigorosamente regulados. A falha em regular adequadamente esses processos pode levar a doenças como o câncer, onde o crescimento dos vasos sanguíneos é descontrolado. A regulamentação precisa necessária para que estes processos funcionem com precisão levanta questões sobre como esta regulamentação poderia evoluir de forma incremental.
Interações célula-célula:A formação de vasos sanguíneos envolve intrincadas interações e comunicação célula-célula. As células precisam responder aos sinais das células vizinhas e do microambiente. Os intermediários evolutivos que não possuem a capacidade de comunicar e interagir adequadamente podem não fornecer qualquer vantagem adaptativa.
Emergência de células sanguíneas: Os vasos sanguíneos requerem células sanguíneas especializadas (células endoteliais e células formadoras de sangue) para funcionar. A evolução destes tipos de células ao longo dos vasos levanta questões sobre a sua origem e desenvolvimento de forma gradual.
Irredutibilidade e Interdependência dos sistemas para instanciar e operar Angiogênese e Vasculogênese
Os processos envolvidos no surgimento da angiogênese são altamente interdependentes:
Fatores Angiogênicos e Proteínas Receptoras: Ambos são necessários para iniciar a sinalização para a formação de vasos.
Moléculas de adesão celular e enzimas de remodelação de matriz: Elas trabalham juntas para organizar as células e criar caminhos para o crescimento.
Fatores de transcrição e genes de diferenciação: Fatores de transcrição ativam genes de diferenciação, orientando a especialização celular.
Vias de sinalização e proteínas de orientação: sinais de sinalização guiam as células por meio de proteínas de orientação, exigindo vias funcionais.
Reguladores citoesqueléticos e sinalização celular: A migração celular adequada depende de sinalização regulada e alterações coordenadas do citoesqueleto.
Reguladores de apoptose e sobrevivência:O equilíbrio do número de células durante a formação dos vasos envolve apoptose e sobrevivência coordenadas.
Comunicação célula-célula e vias de sinalização: A comunicação depende da sinalização funcional, permitindo comportamentos celulares coordenados.
Vias de sinalização celular e regulação do citoesqueleto: A migração celular eficaz requer sinalização sincronizada e alterações no citoesqueleto.
Priming Epigenético e Modificações de Histonas: O priming epigenético prepara o terreno para modificações de histonas para ativar genes relacionados aos vasos. Ambos são essenciais para criar um ambiente propício à cromatina.
Dinâmica de metilação do DNA e regulação de RNA não codificante:Os padrões de metilação do DNA e os RNAs não codificantes trabalham juntos para regular a expressão genética. RNAs não codificantes podem influenciar os padrões de metilação do DNA, ajustando a ativação do gene durante a formação de vasos.
Imprinting e regulação alélica: O imprinting depende de marcas epigenéticas específicas que orientam as funções celulares. A regulação alélica garante a montagem adequada dos vasos, atribuindo funções distintas com base em marcas epigenéticas.
Herança Epigenética e Regulação Temporal: Herança epigenética e regulação temporal estão ligadas. A capacidade de herdar informações epigenéticas auxilia no tempo preciso dos processos relacionados aos vasos.
Supressão de Fatores Antiangiogênicos e Remodelação da Cromatina:A supressão de genes antiangiogênicos e a remodelação adequada da cromatina andam de mãos dadas. Ambos são necessários para a formação desobstruída de vasos.
Regulação epigenética da maturação e detecção de sinais: A regulação da maturação vascular e dos sinais de detecção está interligada. As marcas epigenéticas orientam a maturação dos vasos, enquanto os sinais de detecção permitem a formação adaptativa dos vasos.
Fator Básico de Crescimento e Vias Receptoras: Essas vias dependem umas das outras para estimular comportamentos celulares, como proliferação e migração, essenciais para a formação de vasos.
Quimiotaxia e vias de adesão: A quimiotaxia orienta o movimento celular, enquanto as vias de adesão facilitam a organização celular. Ambos são necessários para a formação coordenada de vasos.
Remodelação Citoesquelética e Comunicação Célula-Célula: As alterações citoesqueléticas são direcionadas por vias de sinalização e influenciam o movimento celular. A comunicação célula-célula eficaz garante um comportamento coordenado durante a angiogênese.
Apoptose e vias de sobrevivência: Equilibrar a apoptose e a sobrevivência é crucial para a formação adequada de vasos. Ambas as vias trabalham juntas para determinar o número e as funções das células.
Sinalização de matriz extracelular e pares ligante-receptor: As células respondem a sinais extracelulares por meio de vias de sinalização, que também envolvem interações ligante-receptor. Esses processos funcionam em conjunto para orientar o comportamento celular durante a formação dos vasos.
Sinalização VEGF e FGF:Ambas as vias promovem a proliferação e migração de células endoteliais. A sua ação combinada é essencial para a formação de vasos.
Sinalização Notch e Wnt: Essas vias provavelmente cooperaram para coordenar a diferenciação de células endoteliais e o surgimento de vasos, garantindo padrões de ramificação adequados.
Sinalização de TGF-β e PDGF: O TGF-β pode ter influenciado a diferenciação de células endoteliais e a remodelação da matriz extracelular, enquanto o PDGF pode ter recrutado células de suporte. Ambas as vias contribuem para a estabilização dos vasos.
Sinalização ECM, MAPK e Rho GTPase: sinalização ECM, vias MAPK e Rho GTPases poderiam ter trabalhado juntas para orientar a migração celular, a dinâmica do citoesqueleto e a montagem de vasos.
Sinalização PI3K/AKT e quimiocina:A via PI3K/AKT provavelmente colaborou com a sinalização de quimiocinas para regular a sobrevivência, migração e posicionamento das células endoteliais durante a brotação dos vasos.
Sinalização Hedgehog e Específica Endotelial: A sinalização Hedgehog e as vias específicas do endotélio poderiam ter se coordenado para regular o padrão vascular, diferenciação, proliferação e formação de tubos.
Código Regulador Transcricional e Linguagem Reguladora Epigenética: A regulação transcricional depende de modificações epigenéticas para o controle adequado da expressão gênica.
Elementos reguladores cis e diafonia da via de sinalização: Os elementos reguladores cis garantem a expressão do gene espaçotemporal, influenciado pela diafonia da via de sinalização.
Códigos de comunicação célula-célula e comunicação imunoendotelial:A comunicação imunoendotelial eficaz requer códigos de comunicação célula-célula coordenados.
Código de sinalização e padronização vascular da matriz extracelular (ECM): As interações da MEC influenciam a padronização vascular, que envolve vias de sinalização que orientam a formação de vasos.
Código de Estabilidade e Maturação e Código de Resposta Inflamatória: A maturação dos vasos sanguíneos está relacionada à regulação da inflamação. A maturação adequada depende de respostas imunológicas coordenadas.
Código de detecção de oxigênio e nutrientes e código de tônus vascular e homeostase: Ambos os códigos contribuem para manter o tônus dos vasos e o fluxo sanguíneo em resposta às mudanças nos sinais ambientais.
Código de troca angiogênica e código de regressão vascular:A ativação e a regressão da angiogênese são processos interconectados que requerem mudanças coordenadas em resposta a sinais.
Código de cicatrização e regeneração de feridas e código de tônus vascular e homeostase: Os vasos sanguíneos desempenham um papel na cicatrização de feridas e no reparo de tecidos, o que afeta o tônus dos vasos e a homeostase.
Os meandros da criação, desenvolvimento e operação de processos biológicos complexos, como angiogênese e vasculogênese, destacam uma profunda interdependência entre os códigos e linguagens de fabricação, sinalização e regulação envolvidos. Esta complexidade levanta questões sobre a viabilidade de uma evolução gradual e gradual e, em vez disso, sugere um design proposital. Os comportamentos das células, incluindo migração, proliferação e diferenciação, são essenciais para a formação de vasos sanguíneos. Sem o código de fabricação, as ações celulares não teriam direção e propósito, impossibilitando a formação de vasos. As vias de sinalização guiam o comportamento celular, transmitindo informações entre as células. Essas dicas instruem as células sobre para onde migrar, quando proliferar e como se diferenciar. Sem os códigos de sinalização, as células não teriam a orientação necessária para executar suas tarefas específicas. Os códigos reguladores orquestram a expressão genética, determinando quais genes são ativados ou suprimidos. Este controle preciso garante que os genes apropriados sejam ativados para apoiar a angiogênese e a vasculogênese. Sem os códigos reguladores, os genes necessários para estes processos não teriam a regulação necessária. As vias de sinalização fornecem pistas para o comportamento celular (fabricação), garantindo que as células migram, proliferam e se diferenciam de maneira coordenada. Sem sinalização adequada, as ações celulares não teriam direção e propósito. Os códigos regulatórios interpretam sinais de sinalização e orientam a expressão genética. As vias de sinalização ativam fatores de transcrição que influenciam os níveis de expressão gênica. Sem sinais de sinalização funcionais, os mecanismos regulatórios não teriam sinais significativos para interpretar. Os comportamentos celulares dependem da expressão genética controlada pelo código regulador. As instruções do código de fabricação são realizadas por meio da expressão de genes específicos. Sem a regulação genética adequada, as células não realizariam os comportamentos necessários para a formação de vasos.
Nesta perspectiva, a intricada interdependência destes códigos sugere uma concepção coordenada, em vez de uma evolução gradual. A emergência simultânea destes sistemas interligados parece implausível através de mudanças incrementais. Em vez disso, aponta para um design proposital onde estes componentes foram criados todos de uma vez, totalmente operacionais, para realizar a complexa tarefa de formar vasos sanguíneos funcionais. A natureza interligada dos aspectos de produção, sinalização e regulação implica que estes sistemas foram instanciados em conjunto, trabalhando em harmonia para alcançar o intricado processo de angiogénese e vasculogénese. Este tipo de interdependência e complexidade alinha-se com o conceito de design inteligente,
Com o que as veias e artérias são interdependentes?
Uma vez que as veias e artérias estejam operacionais, elas são interconectadas com vários sistemas intracelulares e extracelulares para garantir a circulação sanguínea adequada, o fornecimento de nutrientes, a remoção de resíduos e a função fisiológica geral.
Sistemas intracelulares
Contração muscular cardíaca: O batimento cardíaco gerado pelo músculo cardíaco conduz o sangue pelas artérias e veias. A função do sistema circulatório está intimamente ligada à ação de bombeamento do coração.
Produção de células sanguíneas: O sistema circulatório depende da medula óssea para produzir glóbulos vermelhos, glóbulos brancos e plaquetas. Artérias e veias transportam essas células para várias partes do corpo.
Hemostasia e Coagulação:O sistema circulatório interage com a cascata de coagulação para evitar sangramento excessivo de vasos sanguíneos danificados. Plaquetas, fatores de coagulação e células endoteliais desempenham papéis nesse processo.
Troca de oxigênio e dióxido de carbono: O oxigênio do ar inalado se difunde na corrente sanguínea dos pulmões e se liga à hemoglobina. O dióxido de carbono produzido pelas células é transportado pelo sangue de volta aos pulmões para expiração.
Sistemas Extracelulares
Sistema Respiratório: O sistema circulatório colabora com o sistema respiratório para garantir a captação de oxigênio e a remoção de dióxido de carbono. O sangue oxigenado é transportado para as células e o sangue desoxigenado retorna aos pulmões para troca de oxigênio.
Sistema linfático:O sistema linfático ajuda a manter o equilíbrio de fluidos, coletando o excesso de líquido e proteínas que vazaram dos vasos sanguíneos. Os vasos linfáticos devolvem esse fluido à corrente sanguínea, evitando o inchaço.
Sistema endócrino: Os hormônios liberados pelas glândulas endócrinas regulam a pressão arterial, a frequência cardíaca e o equilíbrio eletrolítico, os quais afetam a função das veias e artérias.
Sistema Digestivo: O sistema circulatório transporta nutrientes absorvidos do trato digestivo para as células de todo o corpo. Veias e artérias desempenham um papel na distribuição de nutrientes.
Sistema Nervoso: Os nervos autônomos controlam o diâmetro dos vasos sanguíneos, afetando a pressão arterial e a regulação do fluxo sanguíneo. Os sinais simpáticos e parassimpáticos influenciam a constrição e dilatação dos vasos.
Sistema imunológico: As células imunológicas são transportadas pela corrente sanguínea para locais de infecção ou lesão. Os vasos sanguíneos também desempenham um papel no tráfico de células imunológicas e na inflamação.
Sistema Excretor: Os vasos sanguíneos transportam resíduos para os rins para filtração e eliminação do corpo.
Regulação da temperatura: O fluxo sanguíneo para a superfície da pele ajuda a regular a temperatura corporal. As arteríolas da pele podem dilatar para liberar o excesso de calor ou contrair-se para conservar o calor.
A interdependência das veias e artérias com estes sistemas sublinha o papel do sistema circulatório na manutenção da homeostase geral e no funcionamento adequado de vários processos corporais. A integração destes sistemas garante a coordenação das funções necessárias à sobrevivência e ao desempenho fisiológico ideal.
Premissa 1: A interdependência do sistema circulatório (veias e artérias) com vários sistemas intracelulares e extracelulares é crucial para manter a homeostase geral e a função fisiológica ideal.
Esses sistemas interconectados, incluindo a contração do músculo cardíaco, a produção de células sanguíneas, a hemostasia e a coagulação, as trocas de oxigênio e dióxido de carbono, os sistemas respiratório, linfático, endócrino, digestivo, nervoso, imunológico, excretor e a regulação da temperatura, dependem uns dos outros para desempenhar suas funções. funções.
Premissa 2: Essa interdependência e colaboração intrincadas entre esses diversos sistemas indicam um alto nível de complexidade, precisão e adaptação mútua que parece projetada para uma configuração fisiológica holística e bem coordenada.
Conclusão:A profunda interdependência e adaptação mútua observada entre o sistema circulatório e os vários sistemas interligados sugerem fortemente uma configuração cuidadosamente concebida e integrada. A emergência simultânea destes sistemas, cada um desempenhando um papel crucial na função e manutenção do organismo, implica um plano coordenado em vez de um processo gradual e passo a passo. A harmonia funcional e a coerência entre estes sistemas interdependentes sugerem um design deliberado, garantindo a sobrevivência e o desempenho ideal do organismo.
Premissa 1: O surgimento de vasos sanguíneos e a angiogênese envolve uma infinidade de processos interconectados, incluindo fatores angiogênicos, moléculas de adesão celular, fatores de transcrição, vias de sinalização, reguladores do citoesqueleto e muito mais.
Premissa 2:Esses processos são interdependentes, exigindo ativação simultânea e coordenada para garantir a formação, manutenção e operação adequadas dos vasos.
Conclusão: A intrincada interdependência entre estes processos sugere fortemente que eles não podem ter evoluído passo a passo, como mecanismos ou códigos isolados, mas devem ter sido concebidos e instanciados em conjunto a partir do zero para funcionarem harmoniosamente e atingirem o objetivo complexo de criar, desenvolver e operar. um sistema vascular funcional.
https://elohim.catsboard.com/t375-principais-processos-de-desenvolvimento-que-moldam-a-forma-e-funcao-do-organismo
1. Angiogênese e vasculogênese
2. Apoptose
3. Regulação do ciclo celular
4. Adesão célula-célula e a matriz extracelular (ECM)
5. Comunicação célula-célula
6. Destino celular Determinação e especificação de linhagem
7. Migração celular e quimiotaxia
8. Polaridade e assimetria celular
9. Pluripotência
celular 10. Senescência celular
11. Centrossomos
Dinâmica da cromatina
13. Citocinese
14. Matrizes do citoesqueleto
15. Metilação do DNA
16. Genes de polaridade do ovo
17. Códigos Epigenéticos
18. Rede de Regulação Genética
19. Formação e migração de células germinativas
20. Formação da camada germinativa
21. PTMs de histonas
22. Genes Homeobox e Hox
23. Hormônios
24. Desenvolvimento do sistema imunológico
25. Canais iônicos e campos eletromagnéticos
26. Alvos de membrana
27. Regulação de microRNA
28. Gradientes de morfogênio
29. Morfógenos e Fatores de Crescimento
30. Migração de Células da Crista Neural
31. Poda Neuronal e Sinaptogênese
32. Neurulação e Formação de Tubo Neural
33. RNA Não-codificante de DNA Lixo
34. Maturação e Fertilização de Oócitos
35. Formação de Padrões
36. Segmentação e Somitogênese
40. Vias de Sinalização
41. Regulação e Diferenciação de Células-Tronco
42. Relações Simbióticas e Influência da Microbiota
43. Transposons e Retrotransposons
44. Indução de Tecidos e Organogênese
45. Vascularização e Formação de Vasos Sanguíneos
1. Angiogênese e Vasculogênese
A angiogênese e a vasculogênese são processos essenciais envolvidos na formação e manutenção de vasos sanguíneos nos sistemas biológicos. A angiogênese refere-se à formação de novos vasos sanguíneos a partir dos pré-existentes. Desempenha um papel crucial em vários contextos biológicos, como cicatrização de feridas, regeneração de tecidos e desenvolvimento. A angiogênese produz uma rede de vasos sanguíneos que fornecem nutrientes e oxigênio aos tecidos, removem resíduos e facilitam a troca de moléculas entre a corrente sanguínea e as células circundantes. Este processo é particularmente importante no desenvolvimento embrionário, na reparação e no crescimento de tecidos, bem como em condições como o cancro, onde novos vasos sanguíneos suportam o crescimento do tumor e a metástase. A vasculogênese é o processo pelo qual novos vasos sanguíneos são formados de novo a partir de células progenitoras endoteliais. É particularmente significativo durante o desenvolvimento embrionário, quando o sistema cardiovascular está inicialmente estabelecido. A vasculogênese contribui para a formação do plexo vascular primário, que serve como estrutura para posterior remodelação vascular e o eventual desenvolvimento de uma rede vascular madura. Defeitos na vasculogênese podem levar a graves anormalidades de desenvolvimento. A angiogênese e a vasculogênese são fundamentais para a sobrevivência e função de organismos multicelulares complexos. Eles permitem o transporte eficiente de nutrientes, oxigênio, hormônios e células imunológicas por todo o corpo. Esses processos são vitais para o crescimento, reparo e regeneração dos tecidos, bem como para a manutenção de funções fisiológicas adequadas. Além disso, a angiogênese desempenha um papel em diversas doenças, como câncer, onde a formação excessiva ou aberrante de vasos sanguíneos apoia o crescimento do tumor. A compreensão dos mecanismos moleculares subjacentes à angiogénese e à vasculogénese tem implicações no desenvolvimento de estratégias terapêuticas para condições que envolvem a formação anormal de vasos sanguíneos ou o fornecimento inadequado de sangue aos tecidos.
Aparecimento da angiogênese e da vasculogênese na linha do tempo evolutiva
O aparecimento da angiogênese e da vasculogênese na linha do tempo evolutiva é um tópico complexo que envolve especulação e pesquisas contínuas. Embora o momento exacto não seja definitivamente conhecido, os cientistas propuseram hipóteses sobre quando estes processos poderão ter surgido com base em estudos comparativos e no registo fóssil. A angiogênese e a vasculogênese são processos fundamentais para o desenvolvimento e manutenção dos vasos sanguíneos nos organismos. A angiogênese envolve a formação de novos vasos sanguíneos a partir de vasos pré-existentes, enquanto a vasculogênese se refere à formação de novo de vasos sanguíneos a partir de células precursoras endoteliais.
Formas de vida precoce (procariontes):Esses organismos simples provavelmente não possuíam sistemas vasculares complexos ou mecanismos como angiogênese e vasculogênese. A troca de nutrientes e a remoção de resíduos foram provavelmente facilitadas pela difusão direta através das membranas celulares devido ao seu pequeno tamanho e estrutura relativamente simples.
Eucariontes Simples: À medida que os organismos evoluíram para formas eucarióticas mais complexas, alguns organismos multicelulares começaram a desenvolver mecanismos básicos para transportar nutrientes e resíduos. No entanto, os verdadeiros sistemas vasculares ainda não haviam surgido, e mecanismos como a difusão e a simples organização dos tecidos serviram a esses primeiros organismos.
Invertebrados:O aparecimento de invertebrados mais complexos marcou a transição para sistemas circulatórios mais desenvolvidos. Muitos invertebrados possuem sistemas circulatórios abertos onde o sangue é bombeado para as cavidades corporais, permitindo a troca de nutrientes. Esses sistemas podem ter envolvido processos precursores rudimentares que poderiam ser considerados formas primitivas de angiogênese.
Vertebrados: O surgimento dos vertebrados trouxe sistemas circulatórios mais sofisticados, incluindo sistemas fechados com vasos sanguíneos dedicados. Embora o ponto exato em que a angiogênese e a vasculogênese evoluíram na história dos vertebrados não seja claro, elas provavelmente desempenharam papéis essenciais no desenvolvimento de sistemas vasculares mais avançados.
Primeiros vertebrados:Com o tempo, os vertebrados desenvolveram sistemas cardiovasculares cada vez mais complexos. O surgimento da angiogênese e da vasculogênese poderia ter acompanhado a necessidade de fornecimento mais eficiente de nutrientes, remoção de resíduos e reparo tecidual. Esses processos teriam permitido aos vertebrados sustentar corpos maiores e mais metabolicamente ativos.
Informação Genética De Novo, necessária para instanciar a angiogênese e a vasculogênese
O hipotético surgimento da angiogênese, o processo de formação de novos vasos sanguíneos a partir do zero no desenvolvimento de organismos que anteriormente não possuíam sistema vascular, teria exigido a adição de informações genéticas específicas para possibilitar esse processo complexo. Embora as alterações genéticas exatas sejam especulativas, aqui estão algumas adições ou modificações potenciais na informação genética que poderiam estar envolvidas na evolução da angiogênese:
Fatores Angiogênicos: O desenvolvimento da angiogênese a partir do zero teria exigido a evolução de genes que codificam fatores angiogênicos, como como versões rudimentares de fatores de crescimento endotelial vascular (VEGFs). Esses fatores atuariam como moléculas sinalizadoras para iniciar a formação de vasos.
Proteínas Receptoras:O surgimento da angiogênese teria exigido o desenvolvimento de novas proteínas receptoras em hipotéticas células precursoras do tipo endotelial. Estes receptores permitiriam que as células detectassem e respondessem a factores angiogénicos, iniciando as cascatas de sinalização necessárias para a formação de vasos.
Moléculas de adesão celular: À medida que as células começam a se organizar em vasos sanguíneos, novas informações genéticas podem ter sido necessárias para gerar moléculas primitivas de adesão celular. Essas moléculas facilitariam as interações célula-célula e a formação de estruturas semelhantes a vasos.
Enzimas de remodelação de matriz: A formação inicial de vasos sanguíneos a partir do zero envolveria a quebra e a reestruturação da matriz extracelular. Os genes que codificam enzimas de remodelação da matriz poderiam ter evoluído para permitir que as células criassem caminhos para o crescimento dos vasos.
Fatores de Transcrição: A evolução da angiogênese exigiria novos fatores de transcrição que ativassem programas de expressão gênica específicos para a formação de vasos. Esses fatores regulariam a expressão de genes envolvidos na migração, proliferação e diferenciação celular.
Proteínas de orientação: Para direcionar o movimento das células primitivas do tipo endotelial em direção à formação de vasos sanguíneos, hipotéticas proteínas de orientação poderiam ter evoluído para fornecer sinais direcionais.
Moléculas e vias de sinalização: Novas informações genéticas seriam necessárias para estabelecer as vias de sinalização iniciais que desencadeiam respostas celulares, como migração, proliferação e diferenciação, durante a angiogênese.
Reguladores do citoesqueleto: O desenvolvimento da angiogênese a partir do zero exigiria genes que controlassem a dinâmica do citoesqueleto, permitindo o movimento, a migração e a organização das células em estruturas semelhantes a vasos.
Reguladores de apoptose e sobrevivência: À medida que as células formam vasos sanguíneos, os mecanismos para equilibrar a sobrevivência celular e a morte celular seriam cruciais. Genes envolvidos na apoptose e nas vias de sobrevivência podem ter sido necessários.
Genes de Diferenciação e Especificação: A evolução da angiogênese envolveria o desenvolvimento de genes que especificam e diferenciam células precursoras em células do tipo endotelial com papéis distintos na formação de vasos.
Moléculas de comunicação célula-célula: Novas informações genéticas poderiam ter sido necessárias para permitir que as células se comunicassem e coordenassem seus comportamentos durante a formação dos vasos sanguíneos.
Vias de sinalização celular para coordenação: Para garantir a coordenação adequada entre células semelhantes ao endotélio, a informação genética pode ter evoluído para criar vias rudimentares de sinalização celular para comunicação e sincronização.
Mecanismos reguladores epigenéticos necessários para serem instanciados
O hipotético surgimento da angiogênese “do zero”, ou seja, a evolução da formação de vasos sanguíneos em organismos que anteriormente não possuíam tal sistema, teria exigido o estabelecimento de novas regulamentações epigenéticas para coordenar as complexas alterações celulares necessárias para o desenvolvimento dos vasos.
Preparação Epigenética para Precursores Vasculares: O passo inicial pode ter envolvido o estabelecimento de marcas epigenéticas que preparam certas células precursoras para a diferenciação vascular. Essas marcas poderiam criar um ambiente de cromatina permissivo para genes relacionados à angiogênese.
Modificações de histonas para formação de vasos:A evolução da angiogênese teria exigido o surgimento de modificações específicas de histonas que ativam genes envolvidos no desenvolvimento dos vasos. A acetilação de histonas, por exemplo, poderia aumentar a expressão de genes relacionados à diferenciação endotelial e à formação de tubos.
Dinâmica de metilação do DNA: A formação de vasos sanguíneos exigiria o estabelecimento de padrões específicos de metilação do DNA. Novos padrões poderiam regular a expressão de genes essenciais para a angiogênese, ajustando sua ativação durante diferentes estágios de formação de vasos.
Regulação mediada por RNA não codificante:A evolução da angiogênese pode ter levado ao surgimento de RNAs não codificantes, como microRNAs ou RNAs não codificantes longos, que poderiam interagir com complexos modificadores da cromatina para regular a expressão de genes associados ao desenvolvimento de vasos.
Impressão e regulação alélica: Para garantir a montagem adequada dos vasos, a evolução da angiogênese poderia envolver o estabelecimento de marcas epigenéticas específicas de alelos que orientam as células a adotarem papéis específicos durante a formação dos vasos.
Herança Epigenética de Padrões Vasculares: A capacidade de transmitir informações epigenéticas relacionadas à formação de vasos poderia ter evoluído, permitindo que as gerações subsequentes herdassem as marcas regulatórias necessárias para a angiogênese.
Regulamentos Epigenéticos Temporais:O desenvolvimento coordenado da angiogênese exigiria a evolução de mecanismos epigenéticos que atuassem como “relógios” moleculares, garantindo o tempo preciso dos processos relacionados aos vasos.
Supressão de Fatores Antiangiogênicos: Novas regulamentações epigenéticas poderiam ter evoluído para suprimir a expressão de genes que codificam fatores antiangiogênicos, garantindo que o processo de desenvolvimento dos vasos não fosse prejudicado.
Remodelação da cromatina para montagem de vasos: À medida que células semelhantes ao endotélio se unem para formar vasos, novos mecanismos epigenéticos podem ter sido necessários para regular a remodelação da cromatina, facilitando as interações célula-célula adequadas e a formação de tubos.
Regulação Epigenética da Maturação Vascular:Marcas epigenéticas podem ter sido necessárias para orientar a maturação e estabilização dos vasos recém-formados, incluindo o recrutamento de células de suporte como pericitos e células musculares lisas.
Detecção Epigenética de Sinais Ambientais: A evolução da angiogênese provavelmente exigiria mecanismos epigenéticos que permitissem às células detectar e responder aos sinais ambientais, permitindo a formação adaptativa de vasos em diferentes contextos.
Vias de sinalização necessárias para criar e manter a angiogênese e a vasculogênese
Se considerarmos o surgimento da angiogênese "do zero", ou seja, o desenvolvimento inicial do processo em organismos que anteriormente não possuíam nenhum sistema vascular, possíveis vias de sinalização que teriam que estar envolvidas na evolução hipotética da angiogênese : são:
Fator Básico de Crescimento e Vias Receptoras: O surgimento da angiogênese teria exigido a evolução de vias básicas de fatores de crescimento e sistemas receptores que estimulam a proliferação, migração e diferenciação celular. Cascatas de sinalização simples envolvendo ligantes e receptores podem ter formado a base para uma sinalização angiogênica mais complexa.
Caminhos de quimiotaxia:Hipoteticamente, as vias rudimentares de sinalização quimiotática poderiam ter evoluído para guiar células primitivas do tipo endotelial em direção a gradientes específicos de fatores que promovem o movimento celular. Estas poderiam ter sido versões primitivas de caminhos de desenvolvimento posterior.
Vias de adesão: A angiogênese precoce teria exigido adesão e migração celular. As vias de sinalização relacionadas às moléculas de adesão celular poderiam ter surgido para facilitar o movimento e a organização das células endoteliais em vasos sanguíneos nascentes.
Vias de remodelação do citoesqueleto: A evolução da angiogênese provavelmente teria envolvido mecanismos para alterar a forma e o movimento celular. As vias de sinalização relacionadas ao citoesqueleto, como a dinâmica da actina e dos microtúbulos, poderiam ter sido essenciais.
Vias de comunicação célula-célula: Vias básicas de comunicação célula-célula podem ter se desenvolvido para permitir que células endoteliais primitivas coordenassem seus comportamentos durante os estágios iniciais da formação de vasos.
Apoptose e vias de sobrevivência: Como a formação de vasos requer o equilíbrio preciso entre a morte celular (apoptose) e a sobrevivência celular, vias hipotéticas que regulam estes processos podem ter sido cruciais.
Sinalização inicial da matriz extracelular: As vias de sinalização envolvidas na resposta ao ambiente extracelular poderiam ter surgido para guiar as células para formar estruturas semelhantes ao precursor rudimentar dos vasos sanguíneos.
Evolução dos pares ligante-receptor:Novos pares ligante-receptor podem ter evoluído, permitindo que as células detectem e respondam aos sinais que promovem a formação de vasos.
O surgimento da angiogênese, o processo de formação de novos vasos sanguíneos a partir de vasos pré-existentes, teria envolvido o estabelecimento e a modificação de vias de sinalização específicas para coordenar as complexas alterações celulares necessárias para a formação de vasos. Embora as vias de sinalização exatas sejam especulativas, aqui estão algumas vias potenciais que poderiam estar envolvidas no surgimento da angiogênese:
Via de sinalização do VEGF:O fator de crescimento endotelial vascular (VEGF) é um regulador central da angiogênese. A via de sinalização do VEGF envolve a ligação do VEGF aos seus receptores (VEGFRs) nas células endoteliais. Isso ativa cascatas de sinalização a jusante que promovem a proliferação, migração e formação de tubos de células endoteliais.
Via de sinalização FGF: Fatores de crescimento de fibroblastos (FGFs) também desempenham um papel na angiogênese. A via de sinalização do FGF, semelhante à via do VEGF, envolve a ligação dos ligantes do FGF aos seus receptores, o que desencadeia eventos de sinalização que contribuem para a proliferação e migração das células endoteliais.
Caminho de sinalização de entalhe:A via Notch está envolvida na comunicação célula-célula e poderia ter desempenhado um papel na coordenação da diferenciação das células endoteliais e na seleção das células da ponta durante o surgimento dos vasos.
Via de sinalização Wnt: A via Wnt tem diversas funções no desenvolvimento, e seus componentes podem estar envolvidos na angiogênese, influenciando o comportamento das células endoteliais e os padrões de ramificação dos vasos.
Via de sinalização TGF-β: Os membros da família do fator de crescimento transformador beta (TGF-β) poderiam ter sido implicados na angiogênese, regulando a diferenciação de células endoteliais e a remodelação da matriz extracelular.
Caminho de sinalização PDGF:A sinalização do fator de crescimento derivado de plaquetas (PDGF) pode estar envolvida no recrutamento de pericitos e células musculares lisas para estabilizar e amadurecer vasos recém-formados.
Vias de sinalização da MEC: Os componentes da matriz extracelular (MEC), incluindo integrinas e quinase de adesão focal (FAK), poderiam ter participado na transmissão de sinais que orientam a migração de células endoteliais e a montagem de vasos.
Via de sinalização MAPK: As vias da proteína quinase ativada por mitógeno (MAPK) poderiam ter sido essenciais para a transmissão de sinais que regulam a proliferação, sobrevivência e migração celular durante a angiogênese.
Caminho de sinalização PI3K/AKT:A via fosfatidilinositol 3-quinase (PI3K)/AKT poderia estar envolvida na promoção da sobrevivência das células endoteliais, migração e respostas celulares relacionadas à angiogênese.
Via de sinalização Rho GTPase: Rho GTPases, como Rho, Rac e Cdc42, poderiam ter participado na regulação da dinâmica do citoesqueleto e na migração celular durante a angiogênese.
Sinalização de quimiocinas: As quimiocinas e seus receptores podem ter guiado a migração e o posicionamento das células endoteliais durante o surgimento dos vasos.
Via de sinalização Hedgehog: A sinalização Hedgehog pode ter sido implicada na regulação do padrão vascular e na diferenciação de células endoteliais.
Vias de sinalização específicas do endotélio:As vias de sinalização especificamente ativas nas células endoteliais poderiam ter evoluído para controlar processos relacionados à angiogênese, como proliferação, migração e formação de tubos.
Códigos reguladores necessários para manutenção e operação
O hipotético surgimento de vasos sanguíneos e da angiogênese provavelmente envolveria o estabelecimento de códigos e linguagens reguladoras para coordenar o desenvolvimento, manutenção e operação do sistema vascular. Embora os detalhes exatos sejam especulativos, aqui estão possíveis códigos regulatórios e linguagens que poderiam ter sido instanciados:
Código Regulatório Transcricional:A evolução dos vasos sanguíneos exigiria um código regulador transcricional envolvendo sequências específicas de DNA, fatores de transcrição e elementos reguladores que controlam a expressão de genes envolvidos no desenvolvimento, manutenção e função dos vasos.
Elementos reguladores cis: Intensificadores, promotores e outros elementos reguladores cis precisariam evoluir para garantir a expressão espaço-temporal adequada de genes relacionados à angiogênese.
Linguagem Reguladora Epigenética: Modificações epigenéticas, como metilação do DNA e modificações de histonas, poderiam formar uma linguagem reguladora epigenética que orienta a ativação e repressão de genes essenciais para o desenvolvimento e manutenção vascular.
Crosstalk da via de sinalização:As vias de sinalização complexas envolvidas na angiogénese e na função vascular precisariam de comunicar e coordenar as suas actividades através de uma linguagem reguladora que assegurasse respostas celulares adequadas.
Códigos de comunicação célula-célula: Como os vasos sanguíneos envolvem vários tipos de células, seria necessário um código de comunicação envolvendo receptores de superfície celular, ligantes e suas interações para coordenar comportamentos e funções celulares.
Sinalização da Matriz Extracelular (MEC): Um código envolvendo interações entre as células e a matriz extracelular regularia processos como adesão, migração e sinalização celular.
Código de Padronização Vascular:O estabelecimento de redes hierárquicas de vasos exigiria um código que orientasse a formação e os padrões de ramificação dos vasos sanguíneos para garantir a distribuição eficiente de nutrientes e oxigênio.
Código de Estabilidade e Maturação: A estabilização e maturação dos vasos sanguíneos exigiria um código regulatório envolvendo a comunicação entre as células endoteliais e as células de suporte (pericitos e células musculares lisas) para garantir a integridade estrutural.
Código de detecção de oxigênio e nutrientes: Os vasos sanguíneos precisam se adaptar às mudanças nos níveis de oxigênio e nutrientes. Um código regulador poderia reger a resposta dos navios a estas flutuações, garantindo a dilatação e constrição apropriada dos vasos.
Comunicação Imuno-Endotelial:Os vasos sanguíneos interagem com o sistema imunológico. Seria necessário um código para regular a comunicação entre as células endoteliais e as células do sistema imunológico, permitindo a vigilância imunológica e a regulação da inflamação.
Código de resposta inflamatória: As respostas inflamatórias e os processos de reparação exigiriam um código regulador para ativar e controlar genes específicos envolvidos na reparação de tecidos e na remodelação dos vasos.
Código de tônus vascular e homeostase: A pressão arterial e o tônus dos vasos precisam ser rigorosamente regulados. Seria necessário um código para equilibrar a vasoconstrição e a vasodilatação para manter o fluxo sanguíneo e a homeostase.
Código de troca angiogênica:A transição dos vasos quiescentes para a ativação da angiogênese exigiria um código que detectasse sinais ambientais e desencadeasse respostas angiogênicas.
Código de regressão vascular: os vasos precisam regredir quando não são necessários. Um código regulatório seria necessário para iniciar a regressão dos vasos e a remodelação dos tecidos.
Código de cicatrização e regeneração de feridas: Os vasos sanguíneos desempenham um papel na reparação de tecidos. Um código estaria envolvido na coordenação dos processos relacionados aos vasos durante a cicatrização de feridas e regeneração de tecidos.
Esses códigos e linguagens reguladoras teriam que surgir para garantir o desenvolvimento, a manutenção e a operação dos vasos sanguíneos. Os detalhes precisos dependeriam do contexto específico e dos mecanismos genéticos e moleculares que contribuíram para o surgimento da angiogênese e dos sistemas vasculares. Diferenças entre Angiogênese e Vasculogênese A vasculogênese e a angiogênese são dois processos distintos, mas interconectados, envolvidos na formação e desenvolvimento de vasos sanguíneos dentro de um organismo. Embora partilhem semelhanças, diferem no momento, nos mecanismos e nos contextos. Vasculogênese

A vasculogênese é o processo pelo qual novos vasos sanguíneos são formados de novo (do zero) durante o desenvolvimento embrionário. Ocorre principalmente durante os estágios iniciais da embriogênese, quando o embrião é um aglomerado de células indiferenciadas. Aqui estão as principais diferenças:
Momento: A vasculogênese ocorre muito cedo no desenvolvimento embrionário, muitas vezes antes da formação dos órgãos principais. Envolve a montagem inicial da rede vascular primária.
Origem celular: Durante a vasculogênese, as células precursoras endoteliais, chamadas angioblastos, diferenciam-se das células mesodérmicas. Esses angioblastos agregam-se e coalescem para formar os vasos sanguíneos primitivos.
Organogênese:A vasculogênese está intimamente associada à organogênese. À medida que os órgãos começam a se desenvolver, a rede vascular primária formada pela vasculogênese fornece a base para o subsequente crescimento e desenvolvimento dos órgãos.
Formação de vasos: Na vasculogênese, os angioblastos se agregam para formar estruturas semelhantes a vasos sanguíneos, que então se unem para criar o plexo capilar primário. Este processo envolve a diferenciação e a organização das células endoteliais em estruturas semelhantes a vasos.
Angiogênese
A angiogênese é o processo de formação de novos vasos sanguíneos a partir de vasos pré-existentes. É um processo mais refinado e especializado que ocorre durante vários estágios de desenvolvimento e em resposta a necessidades específicas do corpo. Aqui estão as principais diferenças:
Tempo:A angiogênese pode ocorrer durante o desenvolvimento embrionário e nos estágios pós-natais. Desempenha um papel no crescimento dos tecidos, na cicatrização de feridas e em outros processos ao longo da vida de um organismo.
Origem Celular: Durante a angiogênese, as células endoteliais existentes em vasos sanguíneos preexistentes são ativadas para proliferar, migrar e remodelar, formando novos vasos sanguíneos. Envolve a expansão e remodelação das redes vasculares existentes.
Crescimento e reparo de tecidos: A angiogênese é essencial para o crescimento, reparo e regeneração de tecidos. Permite a expansão da rede vascular para fornecer nutrientes e oxigênio aos tecidos em crescimento ou para auxiliar na cicatrização de tecidos feridos.
Iniciação:A angiogênese é iniciada em resposta a sinais específicos, como hipóxia (baixos níveis de oxigênio) ou fatores de crescimento liberados durante lesão tecidual. Esses sinais ativam as células endoteliais nos vasos existentes para brotar, migrar e formar novos vasos.
Existem evidências científicas que apoiam a ideia de que estes sistemas biológicos foram criados pelo processo de evolução?
Interdependência Funcional: A angiogênese e a vasculogênese envolvem múltiplas etapas interdependentes, incluindo migração celular, proliferação, sinalização e remodelação da MEC. É um desafio imaginar como cada etapa poderia evoluir de forma independente, já que muitos componentes são necessários para que o processo seja funcional.
Redes de Sinalização Complexas:A formação bem sucedida de vasos sanguíneos requer uma coordenação precisa de múltiplas vias de sinalização. Essas vias envolvem interações intrincadas entre fatores de crescimento, moléculas de adesão celular e fatores de transcrição. Para que a angiogênese e a vasculogênese funcionem, essas vias precisam estar instaladas e funcionais simultaneamente.
Estruturas Necessárias: Os vasos sanguíneos requerem uma certa complexidade estrutural para funcionar adequadamente. Os vasos precisam ser capazes de transportar o sangue de forma eficiente, resistir às forças mecânicas e manter as propriedades de barreira. Estes requisitos estruturais tornam improvável que navios parcialmente desenvolvidos ou em fases intermédias proporcionem qualquer vantagem selectiva.
Custos de energia e recursos:O desenvolvimento e a manutenção dos vasos sanguíneos são metabolicamente dispendiosos. A evolução exige que os estágios intermediários ofereçam alguma vantagem seletiva ao organismo. Se os estágios intermediários carecem de funcionalidade e incorrem apenas em custos de energia e recursos, é menos provável que sejam favorecidos pela seleção natural.
Regulação e Controle: Os processos de angiogênese e vasculogênese precisam ser rigorosamente regulados. A falha em regular adequadamente esses processos pode levar a doenças como o câncer, onde o crescimento dos vasos sanguíneos é descontrolado. A regulamentação precisa necessária para que estes processos funcionem com precisão levanta questões sobre como esta regulamentação poderia evoluir de forma incremental.
Interações célula-célula:A formação de vasos sanguíneos envolve intrincadas interações e comunicação célula-célula. As células precisam responder aos sinais das células vizinhas e do microambiente. Os intermediários evolutivos que não possuem a capacidade de comunicar e interagir adequadamente podem não fornecer qualquer vantagem adaptativa.
Emergência de células sanguíneas: Os vasos sanguíneos requerem células sanguíneas especializadas (células endoteliais e células formadoras de sangue) para funcionar. A evolução destes tipos de células ao longo dos vasos levanta questões sobre a sua origem e desenvolvimento de forma gradual.
Irredutibilidade e Interdependência dos sistemas para instanciar e operar Angiogênese e Vasculogênese
Os processos envolvidos no surgimento da angiogênese são altamente interdependentes:
Fatores Angiogênicos e Proteínas Receptoras: Ambos são necessários para iniciar a sinalização para a formação de vasos.
Moléculas de adesão celular e enzimas de remodelação de matriz: Elas trabalham juntas para organizar as células e criar caminhos para o crescimento.
Fatores de transcrição e genes de diferenciação: Fatores de transcrição ativam genes de diferenciação, orientando a especialização celular.
Vias de sinalização e proteínas de orientação: sinais de sinalização guiam as células por meio de proteínas de orientação, exigindo vias funcionais.
Reguladores citoesqueléticos e sinalização celular: A migração celular adequada depende de sinalização regulada e alterações coordenadas do citoesqueleto.
Reguladores de apoptose e sobrevivência:O equilíbrio do número de células durante a formação dos vasos envolve apoptose e sobrevivência coordenadas.
Comunicação célula-célula e vias de sinalização: A comunicação depende da sinalização funcional, permitindo comportamentos celulares coordenados.
Vias de sinalização celular e regulação do citoesqueleto: A migração celular eficaz requer sinalização sincronizada e alterações no citoesqueleto.
Priming Epigenético e Modificações de Histonas: O priming epigenético prepara o terreno para modificações de histonas para ativar genes relacionados aos vasos. Ambos são essenciais para criar um ambiente propício à cromatina.
Dinâmica de metilação do DNA e regulação de RNA não codificante:Os padrões de metilação do DNA e os RNAs não codificantes trabalham juntos para regular a expressão genética. RNAs não codificantes podem influenciar os padrões de metilação do DNA, ajustando a ativação do gene durante a formação de vasos.
Imprinting e regulação alélica: O imprinting depende de marcas epigenéticas específicas que orientam as funções celulares. A regulação alélica garante a montagem adequada dos vasos, atribuindo funções distintas com base em marcas epigenéticas.
Herança Epigenética e Regulação Temporal: Herança epigenética e regulação temporal estão ligadas. A capacidade de herdar informações epigenéticas auxilia no tempo preciso dos processos relacionados aos vasos.
Supressão de Fatores Antiangiogênicos e Remodelação da Cromatina:A supressão de genes antiangiogênicos e a remodelação adequada da cromatina andam de mãos dadas. Ambos são necessários para a formação desobstruída de vasos.
Regulação epigenética da maturação e detecção de sinais: A regulação da maturação vascular e dos sinais de detecção está interligada. As marcas epigenéticas orientam a maturação dos vasos, enquanto os sinais de detecção permitem a formação adaptativa dos vasos.
Fator Básico de Crescimento e Vias Receptoras: Essas vias dependem umas das outras para estimular comportamentos celulares, como proliferação e migração, essenciais para a formação de vasos.
Quimiotaxia e vias de adesão: A quimiotaxia orienta o movimento celular, enquanto as vias de adesão facilitam a organização celular. Ambos são necessários para a formação coordenada de vasos.
Remodelação Citoesquelética e Comunicação Célula-Célula: As alterações citoesqueléticas são direcionadas por vias de sinalização e influenciam o movimento celular. A comunicação célula-célula eficaz garante um comportamento coordenado durante a angiogênese.
Apoptose e vias de sobrevivência: Equilibrar a apoptose e a sobrevivência é crucial para a formação adequada de vasos. Ambas as vias trabalham juntas para determinar o número e as funções das células.
Sinalização de matriz extracelular e pares ligante-receptor: As células respondem a sinais extracelulares por meio de vias de sinalização, que também envolvem interações ligante-receptor. Esses processos funcionam em conjunto para orientar o comportamento celular durante a formação dos vasos.
Sinalização VEGF e FGF:Ambas as vias promovem a proliferação e migração de células endoteliais. A sua ação combinada é essencial para a formação de vasos.
Sinalização Notch e Wnt: Essas vias provavelmente cooperaram para coordenar a diferenciação de células endoteliais e o surgimento de vasos, garantindo padrões de ramificação adequados.
Sinalização de TGF-β e PDGF: O TGF-β pode ter influenciado a diferenciação de células endoteliais e a remodelação da matriz extracelular, enquanto o PDGF pode ter recrutado células de suporte. Ambas as vias contribuem para a estabilização dos vasos.
Sinalização ECM, MAPK e Rho GTPase: sinalização ECM, vias MAPK e Rho GTPases poderiam ter trabalhado juntas para orientar a migração celular, a dinâmica do citoesqueleto e a montagem de vasos.
Sinalização PI3K/AKT e quimiocina:A via PI3K/AKT provavelmente colaborou com a sinalização de quimiocinas para regular a sobrevivência, migração e posicionamento das células endoteliais durante a brotação dos vasos.
Sinalização Hedgehog e Específica Endotelial: A sinalização Hedgehog e as vias específicas do endotélio poderiam ter se coordenado para regular o padrão vascular, diferenciação, proliferação e formação de tubos.
Código Regulador Transcricional e Linguagem Reguladora Epigenética: A regulação transcricional depende de modificações epigenéticas para o controle adequado da expressão gênica.
Elementos reguladores cis e diafonia da via de sinalização: Os elementos reguladores cis garantem a expressão do gene espaçotemporal, influenciado pela diafonia da via de sinalização.
Códigos de comunicação célula-célula e comunicação imunoendotelial:A comunicação imunoendotelial eficaz requer códigos de comunicação célula-célula coordenados.
Código de sinalização e padronização vascular da matriz extracelular (ECM): As interações da MEC influenciam a padronização vascular, que envolve vias de sinalização que orientam a formação de vasos.
Código de Estabilidade e Maturação e Código de Resposta Inflamatória: A maturação dos vasos sanguíneos está relacionada à regulação da inflamação. A maturação adequada depende de respostas imunológicas coordenadas.
Código de detecção de oxigênio e nutrientes e código de tônus vascular e homeostase: Ambos os códigos contribuem para manter o tônus dos vasos e o fluxo sanguíneo em resposta às mudanças nos sinais ambientais.
Código de troca angiogênica e código de regressão vascular:A ativação e a regressão da angiogênese são processos interconectados que requerem mudanças coordenadas em resposta a sinais.
Código de cicatrização e regeneração de feridas e código de tônus vascular e homeostase: Os vasos sanguíneos desempenham um papel na cicatrização de feridas e no reparo de tecidos, o que afeta o tônus dos vasos e a homeostase.
Os meandros da criação, desenvolvimento e operação de processos biológicos complexos, como angiogênese e vasculogênese, destacam uma profunda interdependência entre os códigos e linguagens de fabricação, sinalização e regulação envolvidos. Esta complexidade levanta questões sobre a viabilidade de uma evolução gradual e gradual e, em vez disso, sugere um design proposital. Os comportamentos das células, incluindo migração, proliferação e diferenciação, são essenciais para a formação de vasos sanguíneos. Sem o código de fabricação, as ações celulares não teriam direção e propósito, impossibilitando a formação de vasos. As vias de sinalização guiam o comportamento celular, transmitindo informações entre as células. Essas dicas instruem as células sobre para onde migrar, quando proliferar e como se diferenciar. Sem os códigos de sinalização, as células não teriam a orientação necessária para executar suas tarefas específicas. Os códigos reguladores orquestram a expressão genética, determinando quais genes são ativados ou suprimidos. Este controle preciso garante que os genes apropriados sejam ativados para apoiar a angiogênese e a vasculogênese. Sem os códigos reguladores, os genes necessários para estes processos não teriam a regulação necessária. As vias de sinalização fornecem pistas para o comportamento celular (fabricação), garantindo que as células migram, proliferam e se diferenciam de maneira coordenada. Sem sinalização adequada, as ações celulares não teriam direção e propósito. Os códigos regulatórios interpretam sinais de sinalização e orientam a expressão genética. As vias de sinalização ativam fatores de transcrição que influenciam os níveis de expressão gênica. Sem sinais de sinalização funcionais, os mecanismos regulatórios não teriam sinais significativos para interpretar. Os comportamentos celulares dependem da expressão genética controlada pelo código regulador. As instruções do código de fabricação são realizadas por meio da expressão de genes específicos. Sem a regulação genética adequada, as células não realizariam os comportamentos necessários para a formação de vasos.
Nesta perspectiva, a intricada interdependência destes códigos sugere uma concepção coordenada, em vez de uma evolução gradual. A emergência simultânea destes sistemas interligados parece implausível através de mudanças incrementais. Em vez disso, aponta para um design proposital onde estes componentes foram criados todos de uma vez, totalmente operacionais, para realizar a complexa tarefa de formar vasos sanguíneos funcionais. A natureza interligada dos aspectos de produção, sinalização e regulação implica que estes sistemas foram instanciados em conjunto, trabalhando em harmonia para alcançar o intricado processo de angiogénese e vasculogénese. Este tipo de interdependência e complexidade alinha-se com o conceito de design inteligente,
Com o que as veias e artérias são interdependentes?
Uma vez que as veias e artérias estejam operacionais, elas são interconectadas com vários sistemas intracelulares e extracelulares para garantir a circulação sanguínea adequada, o fornecimento de nutrientes, a remoção de resíduos e a função fisiológica geral.
Sistemas intracelulares
Contração muscular cardíaca: O batimento cardíaco gerado pelo músculo cardíaco conduz o sangue pelas artérias e veias. A função do sistema circulatório está intimamente ligada à ação de bombeamento do coração.
Produção de células sanguíneas: O sistema circulatório depende da medula óssea para produzir glóbulos vermelhos, glóbulos brancos e plaquetas. Artérias e veias transportam essas células para várias partes do corpo.
Hemostasia e Coagulação:O sistema circulatório interage com a cascata de coagulação para evitar sangramento excessivo de vasos sanguíneos danificados. Plaquetas, fatores de coagulação e células endoteliais desempenham papéis nesse processo.
Troca de oxigênio e dióxido de carbono: O oxigênio do ar inalado se difunde na corrente sanguínea dos pulmões e se liga à hemoglobina. O dióxido de carbono produzido pelas células é transportado pelo sangue de volta aos pulmões para expiração.
Sistemas Extracelulares
Sistema Respiratório: O sistema circulatório colabora com o sistema respiratório para garantir a captação de oxigênio e a remoção de dióxido de carbono. O sangue oxigenado é transportado para as células e o sangue desoxigenado retorna aos pulmões para troca de oxigênio.
Sistema linfático:O sistema linfático ajuda a manter o equilíbrio de fluidos, coletando o excesso de líquido e proteínas que vazaram dos vasos sanguíneos. Os vasos linfáticos devolvem esse fluido à corrente sanguínea, evitando o inchaço.
Sistema endócrino: Os hormônios liberados pelas glândulas endócrinas regulam a pressão arterial, a frequência cardíaca e o equilíbrio eletrolítico, os quais afetam a função das veias e artérias.
Sistema Digestivo: O sistema circulatório transporta nutrientes absorvidos do trato digestivo para as células de todo o corpo. Veias e artérias desempenham um papel na distribuição de nutrientes.
Sistema Nervoso: Os nervos autônomos controlam o diâmetro dos vasos sanguíneos, afetando a pressão arterial e a regulação do fluxo sanguíneo. Os sinais simpáticos e parassimpáticos influenciam a constrição e dilatação dos vasos.
Sistema imunológico: As células imunológicas são transportadas pela corrente sanguínea para locais de infecção ou lesão. Os vasos sanguíneos também desempenham um papel no tráfico de células imunológicas e na inflamação.
Sistema Excretor: Os vasos sanguíneos transportam resíduos para os rins para filtração e eliminação do corpo.
Regulação da temperatura: O fluxo sanguíneo para a superfície da pele ajuda a regular a temperatura corporal. As arteríolas da pele podem dilatar para liberar o excesso de calor ou contrair-se para conservar o calor.
A interdependência das veias e artérias com estes sistemas sublinha o papel do sistema circulatório na manutenção da homeostase geral e no funcionamento adequado de vários processos corporais. A integração destes sistemas garante a coordenação das funções necessárias à sobrevivência e ao desempenho fisiológico ideal.
Premissa 1: A interdependência do sistema circulatório (veias e artérias) com vários sistemas intracelulares e extracelulares é crucial para manter a homeostase geral e a função fisiológica ideal.
Esses sistemas interconectados, incluindo a contração do músculo cardíaco, a produção de células sanguíneas, a hemostasia e a coagulação, as trocas de oxigênio e dióxido de carbono, os sistemas respiratório, linfático, endócrino, digestivo, nervoso, imunológico, excretor e a regulação da temperatura, dependem uns dos outros para desempenhar suas funções. funções.
Premissa 2: Essa interdependência e colaboração intrincadas entre esses diversos sistemas indicam um alto nível de complexidade, precisão e adaptação mútua que parece projetada para uma configuração fisiológica holística e bem coordenada.
Conclusão:A profunda interdependência e adaptação mútua observada entre o sistema circulatório e os vários sistemas interligados sugerem fortemente uma configuração cuidadosamente concebida e integrada. A emergência simultânea destes sistemas, cada um desempenhando um papel crucial na função e manutenção do organismo, implica um plano coordenado em vez de um processo gradual e passo a passo. A harmonia funcional e a coerência entre estes sistemas interdependentes sugerem um design deliberado, garantindo a sobrevivência e o desempenho ideal do organismo.
Premissa 1: O surgimento de vasos sanguíneos e a angiogênese envolve uma infinidade de processos interconectados, incluindo fatores angiogênicos, moléculas de adesão celular, fatores de transcrição, vias de sinalização, reguladores do citoesqueleto e muito mais.
Premissa 2:Esses processos são interdependentes, exigindo ativação simultânea e coordenada para garantir a formação, manutenção e operação adequadas dos vasos.
Conclusão: A intrincada interdependência entre estes processos sugere fortemente que eles não podem ter evoluído passo a passo, como mecanismos ou códigos isolados, mas devem ter sido concebidos e instanciados em conjunto a partir do zero para funcionarem harmoniosamente e atingirem o objetivo complexo de criar, desenvolver e operar. um sistema vascular funcional.
Última edição por Admin em Dom Ago 27, 2023 7:52 am, editado 1 vez(es)